|
百济神州替雷利珠单抗注射液新适应症上市申请获得CDE受理
8月30日,CDE官网显示,百济神州的替雷利珠单抗注射液(商品名:百泽安)新适应症上市申请获得CDE受理(受理号:CXSS2300071)。根据临床试验进展及百济神州的半年报披露,推测本次递交上市申请的新适应症是一线治疗广泛期小细胞肺癌(ES-SCLC)。

本次上市申请基于III期RATIONALE 312(NCT04005716)研究的积极数据。RATIONALE 312是一项对比替雷利珠单抗联合化疗(A组)和安慰剂联合化疗(B组)作为未经治疗的广泛期小细胞肺癌患者一线治疗有效性的随机、双盲、安慰剂对照、多中心III期临床试验。RATIONALE 312的主要终点为总生存期(OS)。次要终点包括客观缓解率、缓解持续时间(根据RECIST v1.1版)和无进展生存期。
5月26日,百济神州宣布,III期RATIONALE 312研究达到其总生存期(OS)的主要终点,即相较于化疗,替雷利珠单抗联合化疗在未经治疗的广泛期小细胞肺癌(ES-SCLC)患者中展现出OS优效性。与此同时,试验未发现新的安全性警示。
此前,替雷利珠单抗已有11项适应症获NMPA批准,其中包括2023年获得批准的联合化疗用于不可切除的局部晚期、复发或转移性食管鳞状细胞癌患者的一线治疗。
BMS罗特西普获FDA批准一线治疗较低危骨髓增生异常综合征
8月28日,BMS宣布,FDA已经批准Reblozyl(luspatercept,罗特西普)用于治疗极低至中等风险骨髓增生异常综合征(MDS)成人患者,这些患者未接受过促红细胞生成剂(ESA-naïve),可能需要定期输注红细胞(RBC)。

该新适应症的扩展主要基于一项III期COMMANDS研究结果。COMMANDS是一项随机、开放标签的III期临床试验,旨在评估罗特西普与刺激红细胞生成药物epoetin alfa治疗极低至中等风险MDS患者的有效性和安全性。
结果显示,与对照组相比,接受罗特西普治疗的患者在血红蛋白增加的同时获得了更优秀的输血独立性,其数值几乎是前者的两倍,且在临床相关亚组中也表现出这一特点。
罗特西普是一种全球首创的红细胞成熟剂,用于调节晚期红细胞成熟,提高血红蛋白水平。此前2019年11月,罗特西普已在美国获批用于治疗需要定期输注红细胞(RBC)的成人β-地中海贫血患者,2020年4月在美国和欧盟获批治疗MDS伴环形铁粒幼细胞或骨髓增生异常/骨髓增殖性肿瘤伴环形铁粒幼细胞和血小板增多相关贫血。
2022年1月,罗特西普在中国获批用于治疗需要定期输注红细胞且红细胞输注≤15单位/24周的β-地中海贫血成人患者。
阿斯利康AZD5335临床试验获得受理
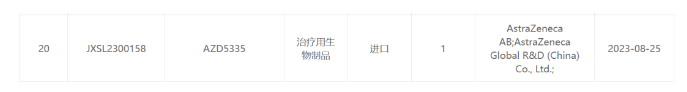
8月25日,CDE官方显示,阿斯利康提交AZD5335的临床试验获得受理。AZD5335 是由FRα 抗体偶联其专有的 TOP1抑制剂 AZ14170132,DAR为8。今年AACR年会上首次公布了临床前数据,对FRα低表达或高表达卵巢癌均体现出治疗潜力。
研究表明2.5 mg/kg AZD5335在表达FRα的卵巢癌细胞系异种移植(CDX)中产生持久抗肿瘤活性,14/17例(82%)卵巢癌PDX模型中,肿瘤生长抑制(TGI)为75%-94%;在评估的14/17(82%)卵巢癌患者的异种移植模型(PDX)中,中位最佳肿瘤皱缩>30%。
此外,在两种FRα低-中表达PDX模型中,AZD5335在同等或更高剂量下,具有比微管抑制剂(MTI)的FRα ADC更优异的抗肿瘤活性和反应持续时间。
FRα近年是癌症药物开发的热门靶点,尤其是卵巢癌,其中ADC药物居多。该靶点目前仅上市一款FRα ADC药物(MIRV),国内已纳入优先审评。治疗FRα高表达的铂耐药卵巢癌患者ORR为32.4%。其次,国内同宜医药、普方生物,百奥泰和天士力均有布局,其中国内进展较快的是同宜医药的CBP-1008,处于II期,是全球首个FRα/TRPV6双抗ADC。
阿斯利康AZD5305临床试验获得受理
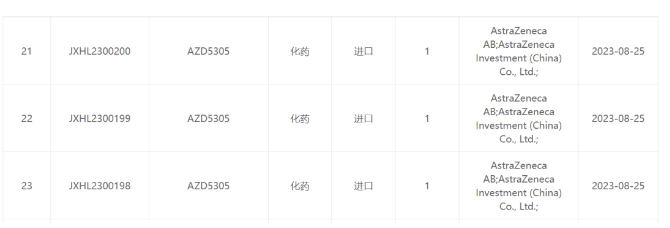
AZD5305 是阿斯利康的第 2 款 PAPR 抑制剂。与已上市的 PARP1/2 抑制剂奥拉帕利不同,AZD5305 对 PARP1 亚型有高选择性,因而有望克服已上市 PARP 抑制剂的副作用。
PARP 抑制剂在同源重组缺陷癌症患者中已经表现出了优异的临床疗效,然而无论是单药使用还是联合疗法,血液学毒性和其他毒性都限制了这类药物的应用。近期文献表明,这部分不良反应可能来源于已上市 PARP 抑制剂对于 PARP2 的抑制,而 PARP2 并非疗效所必须。因此,阿斯利康设计了选择性抑制剂 AZD5305,旨在克服已有 PARP 抑制剂的副作用,构建下一代 PARP 抑制剂。
2021 AACR 会议上,阿斯利康首次披露了 AZD5305 的结构及早期数据。作为一种高效的 PARP1 选择性抑制剂,AZD5305 在具备显著 PARP1-DNA 捕获活性的同时无 PARP2 活性,也不结合 PARP 家族任何其他成员。该药具有优异的二级药理学和理化特性,且在临床前动物模型中表现出高口服生物利用度。在临床前毒理学模型中,AZD5305 显示出了优于奥拉帕利的特性。当在大鼠中以临床等效剂量给药 14 天后,奥拉帕尼(PARP1/2 抑制剂)可导致血红蛋白减少多达 50%,与临床观察到的贫血一致;而相同的实验条件下,当以预测的临床有效剂量给药时,AZD5305 对任何血液学参数都没有影响。
在体外,AZD5305 选择性抑制 DNA 修复途径缺陷细胞系的生长,其 IC50 在个位数 nM 范围内,而在其他细胞中没有或几乎没有生长抑制作用(IC50 >10μM),这表明 AZD5305 在临床上具有改善的治疗指数的巨大潜力。与奥拉帕利 100 mg/kg QD 相比,用 AZD5305 ≥ 0.1 mg/kg QD 治疗 PDX 模型可使肿瘤消退程度更深,停止给药后疗效持续时间也显著延长。
基于这些令人鼓舞的临床前数据,AZD5305 有望成为较其他 PARP 抑制剂具有更强疗效和安全性的下一代 PARP 抑制剂,且具有作为单一疗法和组合疗法的多种临床开发选择,被视为阿斯利康重磅炸弹奥拉帕利的潜在继任者。
强生JNJ-77242113-AAC片临床试验获得受理
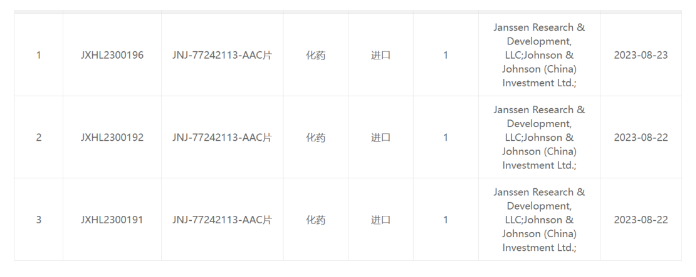
据悉,JNJ-77242113-AAC片是一款口服IL-23受体拮抗剂。早先,杨森公司与Protagonist Therapeutics公司达成一项近10亿美元合作,获得后者口服IL-23受体拮抗剂的开发与商业化的全球独家授权。
IL-23是一种与炎症有关的细胞因子,IL-23通路被认为与许多慢性免疫疾病有关。公开资料显示,全球范围内已有多款IL-23抗体获批,用于治疗克罗恩病、银屑病、银屑病关节炎等自身免疫性疾病,其中也包括了杨森公司的抗IL-23单克隆抗体Tremfya (guselkumab)。
JNJ-77242113(原代号:PN-235)最初由Protagonist Therapeutics公司通过多肽技术平台而开发。Protagonist公司致力于利用多肽技术平台,开发靶向细胞因子、GPCR、离子通道等的激动剂或拮抗剂,并通过专有技术对潜在候选药物进行优化,从而改变其特异性、选择性、溶解度等。2017年,Protagonist公司与杨森公司达成合作,双方将共同开发口服IL-23受体拮抗剂,杨森公司将负责相关产品进入2期临床之后的进一步开发和商业化。
|