|
创新和仿制的平衡是医药产业生态维持健康的基础保障。想要在保护原研药鼓励创新积极性与鼓励仿制药提高药物可及性之间做到平衡,就需要健全的法律体系。值得庆幸的是,我国在2021年7月终于颁布了《药品专利纠纷早期解决机制实施办法》,正式上线了中国上市药品专利信息登记平台,标志着我国的“专利链接制度”正式落地,为专利药和仿制药的和谐发展打下了良好的基础。
今年初,正大天晴研发的依维莫司片(晴维时)正式获批上市,成为了国内药品专利链接制度实施两年半以来,首个以“首仿获批+首个挑战专利成功”的身份获得12个月市场独占期“奖励”的仿制药。这背后凝结着药企研发、注册、专利等部门的高度协同配合。可以说,缺少了任合一方的努力,都不可能获得12个月市场独占期这一殊荣。
据医药魔方PharmaGO数据库统计,2023年,NMPA共批准了113款首仿药(包括新剂型药物),其中有47款首仿药最值得关注,这些药物均为单一剂型仿制药的首次批准,在此之前中国市场没有国产药物或仅有原研上市。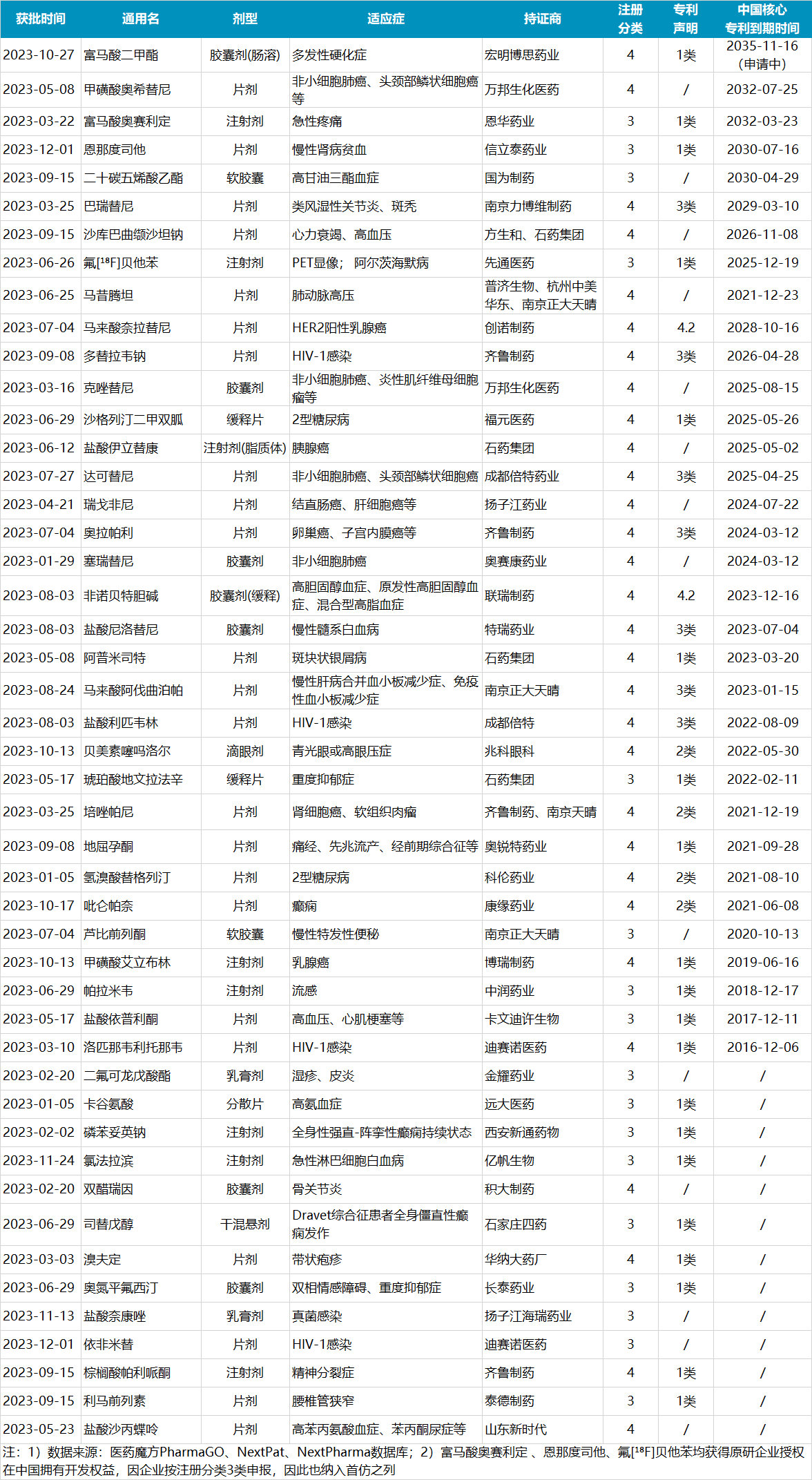 这是否意味着这些药物作为首仿会有更大的市场优势呢?因篇幅有限,本文将对这47款首仿药中,原研年销售峰值TOP10产品的中国竞争情况以及原研在中国的核心专利情况做一简单分析。 这是否意味着这些药物作为首仿会有更大的市场优势呢?因篇幅有限,本文将对这47款首仿药中,原研年销售峰值TOP10产品的中国竞争情况以及原研在中国的核心专利情况做一简单分析。
1. 甲磺酸奥希替尼片
原研企业:阿斯利康
首仿企业:江苏万邦生化医药
中国核心专利到期时间:2032年7月25日
全球销售峰值:尚未达销售峰值,2022年为54.44亿美元
奥希替尼(商品名:泰瑞沙®)是阿斯利康开发的不可逆三代EGFR酪氨酸激酶抑制剂(TKI),可同时抑制EGFR敏感突变和EGFR-T790M耐药突变,与第一代和第二代EGFR-TKIs相比,其穿透血脑屏障的能力更强,对合并中枢神经系统转移的患者具有很好的疗效。
奥希替尼于2015年获美国FDA批准上市,从进入临床到上市仅用了2年,成为了美国有史以来上市最快的抗癌药。随着在全球的上市,该药物销售额持续走高,如今已创下54.44亿美元的年销售额,是阿斯利康所有产品中的销冠。
2017年3月,奥希替尼在中国获批上市,从受理到获NMPA批准仅用了7个月,创下了进口药在中国获批最快速度。截至目前在国内获批3项适应症且均被纳入医保。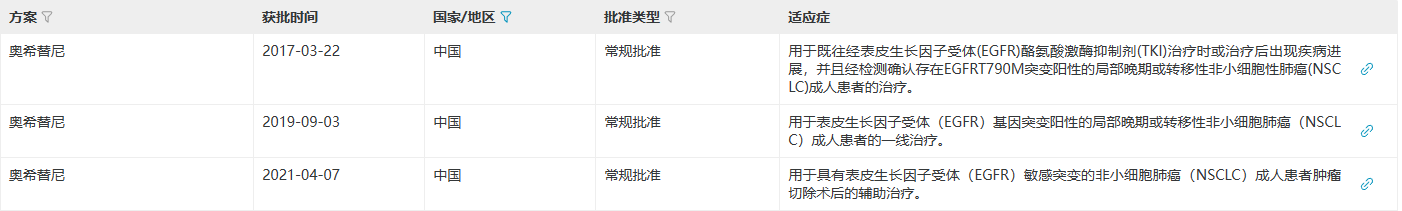 来源:医药魔方NextPharma数据库 来源:医药魔方NextPharma数据库
根据医药魔方NextPat数据库,阿斯利康在中国专利平台共登记了奥希替尼3项专利,分别保护了具体化合物和制剂,这3项专利均被授权,且处于保护期内,化合物专利到期时间为2032年7月25日,这也就意味着在没有仿制药企业专利挑战成功情况下,短期内原研产品还不会面临竞品威胁。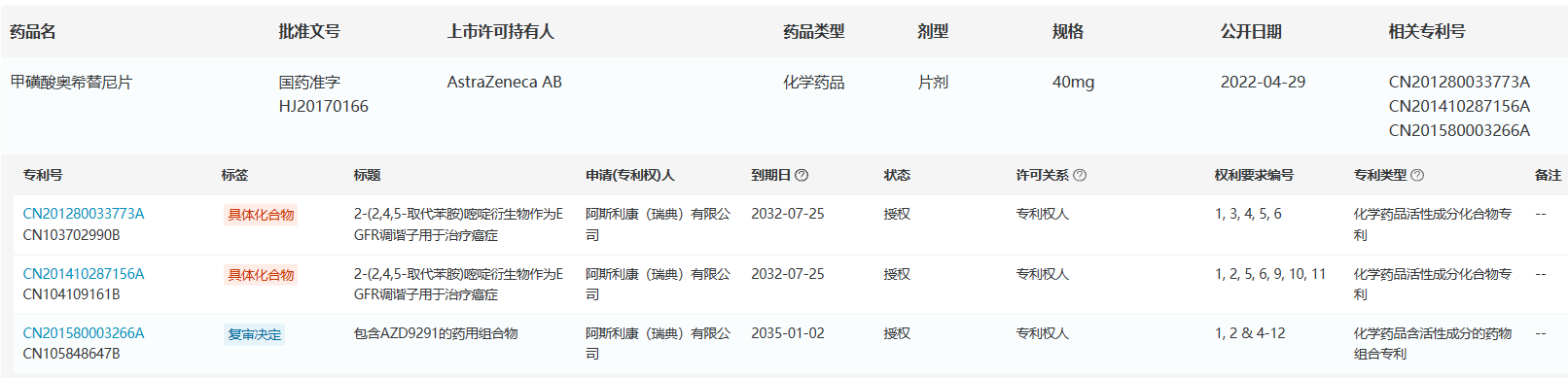 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
根据医药魔方PharmaGO数据库,从现有仿制药获批和申报情况来看,除了万邦生化医药已经获得首仿资格外,尚无其他药企业开展该品种的生物等效性试验(BE)和申报上市。由于万邦生化医药于2021年5月向CDE申报上市申请,故未在中国专利平台进行声明,也未见其对该药品专利发起挑战相关信息。因此,就目前信息推测,万邦生化医药尚不能在中国市场销售奥希替尼仿制药,否则可能会面临专利纠纷。
虽然,奥希替尼在中国市场无需面临仿制药的竞争。不过,近几年上市的Me too类创新药阿美替尼(豪森)、伏美替尼(艾力斯)也在不断蚕食其中国市场份额。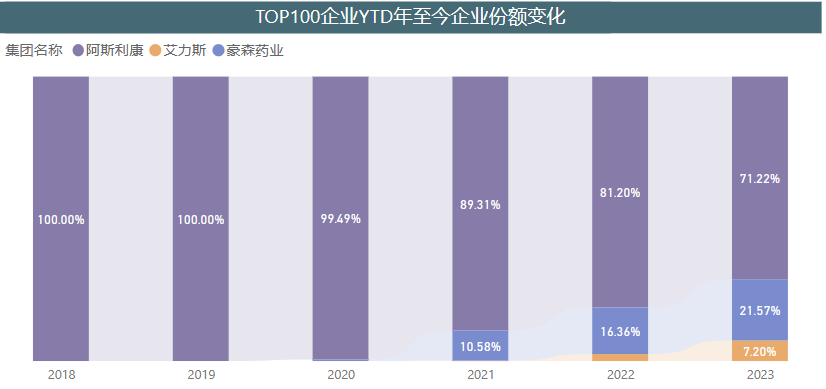 来源:医药魔方PharmaBI数据库 来源:医药魔方PharmaBI数据库
除了三代产品的市场竞争外,多家企业正在开发四代EGFR-TKI,以克服三代产品耐药问题。包括再鼎医药(BLU-945和BLU-701)、正大天晴(TQB3804)、豪森药业(HS-10375)等。
推荐阅读:EGFRm肺癌新药开发二十年:前有故友,后有新朋
2. 沙库巴曲缬沙坦钠片
原研企业:诺华
首仿企业:方生和医药、石药集团
中国核心专利到期时间:2026年11月8日
全球销售峰值:尚未达销售峰值,2022年为46.44亿美元
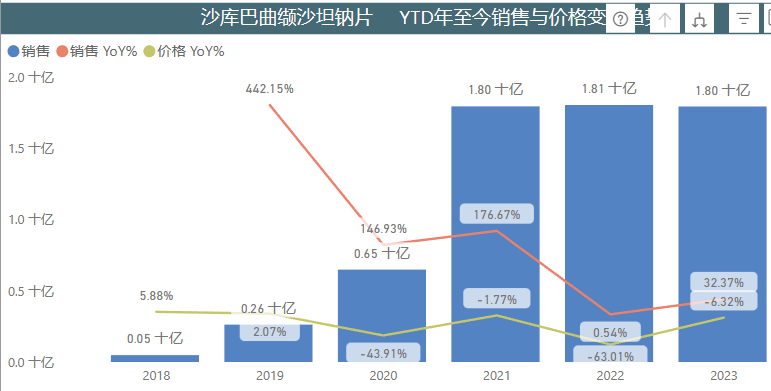
沙库巴曲缬沙坦钠片(商品名:诺欣妥®)是诺华开发的重磅心衰产品,代表了心衰新药研发领域20多年来的重大突破。其临床价值也通过销售业绩充分体现,2022年该药品全球销售额达到46.44亿美元,销售表现仅次于诺华的司库奇优单抗,2023年有潜力反超后者。
原研产品于2017年6月在中国获批上市,2023年前3季度国内医院终端销售额高达18亿元。
 来源:医药魔方PharmaBI数据库 来源:医药魔方PharmaBI数据库
沙库巴曲缬沙坦钠片的巨大市场潜力吸引了国内众多厂家布局。继2023年8月南京一心和与石药集团同日获得药品批件后,陆续有正大天晴、信立泰、科伦、倍特、华瀚、齐鲁等10家企业获得该产品批件。
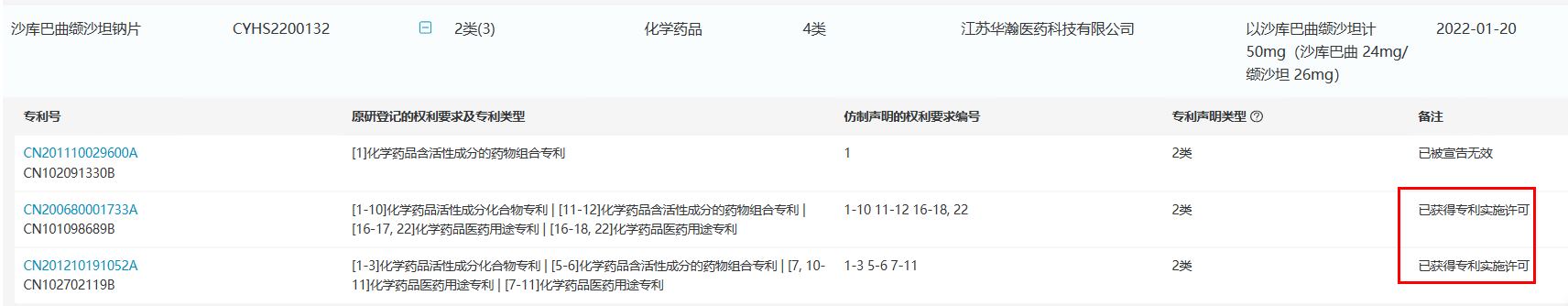
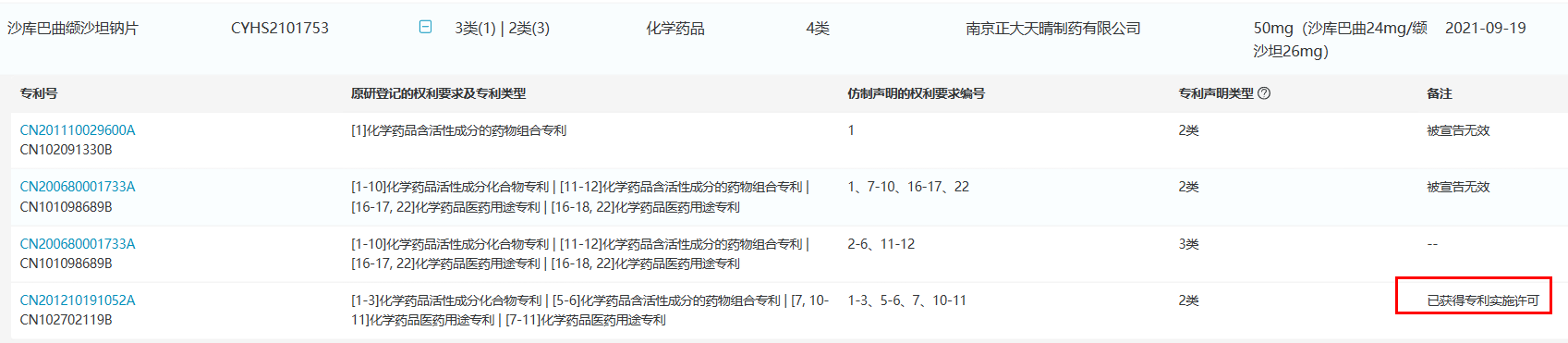
不过,获批不等于能够立刻上市。目前,诺华登记的沙库巴曲缬沙坦钠片组合物专利在中国已经被宣告无效,扫清了国内仿制药上市销售的初步障碍,但真正制约国内仿制药的晶型专利(专利号:ZL200680001733.0 / ZL201210191052.2)可让诺欣妥®在中国市场的独占期持续到2026年11月。
南京一心和宣称其一心坦®是具有全新晶型的沙库巴曲缬沙坦钠片,上市销售不受原研专利限制;江苏华瀚和南京正大天晴得到原研诺华药业的专利授权,可无需等到2026年11月后上市销售。浙江昂利康制药提交了4.2类声明(仿制药未落入登记平台收录的被仿制药品相关专利权保护范围),其余厂家则登记了3类声明(即承诺在相应专利权有效期届满之前所申请的仿制药暂不上市)。
来源:医药魔方NextPat数据库
3. 富马酸二甲酯肠溶胶囊
原研企业:渤健
首仿企业:宏明博思药业
中国核心专利到期时间:2035/11/16(申请中)
全球销售峰值:44.33亿美元(2019年)
富马酸二甲酯(商品名:特菲达®)最早于2013年3月获得FDA批准上市,是继芬戈莫德、特立氟胺之后全球上市的第3款口服多发性硬化症(MS)药物,也是渤健的头牌产品,2019年全球销售峰值达到44.33亿美元。随着2020年迈兰挑战其专利成功,仿制药上市后该产品受到明显冲击,多款MS新药相继获批上市也导致其市场份额持续下滑,2022年全球收入仅14.4亿美元。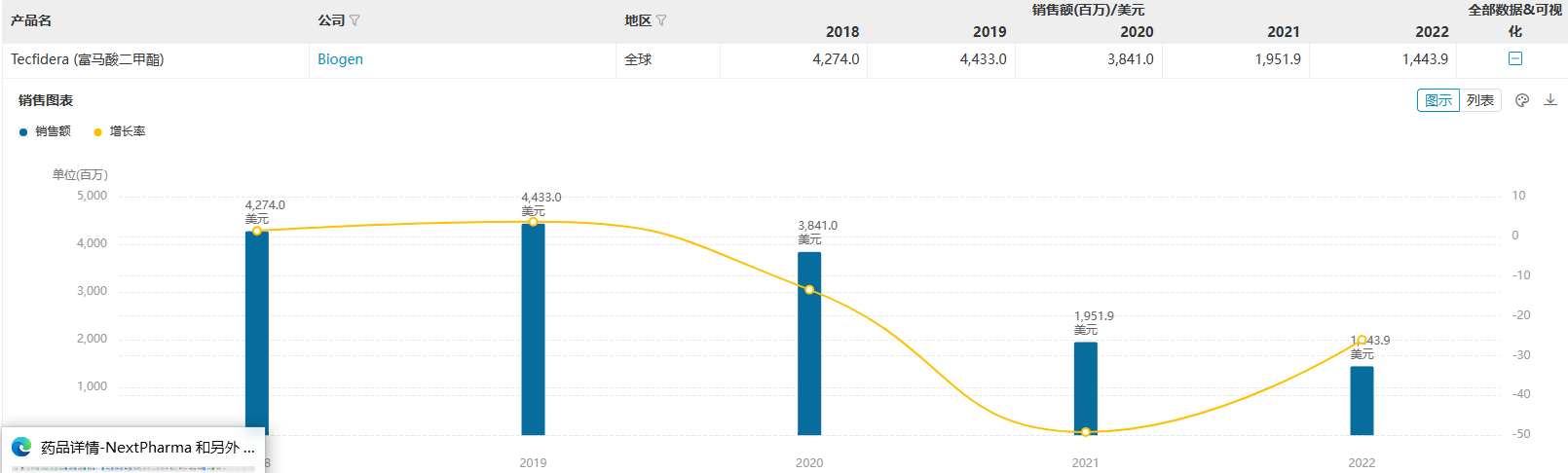 来源:医药魔方NextPharma 来源:医药魔方NextPharma
数据库2020年11月,该药物被NMPA药品审评中心列入《第三批临床急需境外新药名单》并获优先审评资格,于2021年4月在中国获批上市。
富马酸二甲酯是工业上常用的防潮防霉原料,分子结构简单,化合物本身并不受专利保护。然而,作为多发性硬化症治疗药物,其受到一系列治疗方法及医药用途专利的保护。据医药魔方NextPat数据库,该药品目前有多个中国医药用途专利正在申请过程中。 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
目前国内仅宏博药业开发的富马酸二甲酯肠溶胶囊首仿药获批上市并开始上市销售。齐鲁制药、人福药业以及Dr. Reddy's开发的仿制药正在接受CDE审评。华海医药的富马酸二甲酯肠溶胶囊成功获美国FDA批准上市。
4. 奥拉帕利片
原研企业:阿斯利康
首仿企业:齐鲁制药
中国核心专利到期时间:2024年3月12日
全球销售峰值:尚未达销售峰值,2022年为26.4亿美元
奥拉帕利片(商品名:利普卓®)是全球首款获批上市的PARP抑制剂。于2014年12月获FDA批准上市。截至目前,已相继斩获卵巢癌、乳腺癌、去势抵抗性前列腺癌、胰腺癌、输卵管癌、腹膜癌等多项适应症。自上市以来,奥拉帕利的销售额逐年增长,2022年阿斯利康财报披露的全年销售额已达26.38亿美元。
奥拉帕利片于2018年8月在国内获批上市,目前占据着中国PARP抑制剂医药终端市场大部分份额,不过也可以看出其他Me too类新药尼拉帕利、帕米帕利、氟唑帕利对其市场份额的逐渐挤压。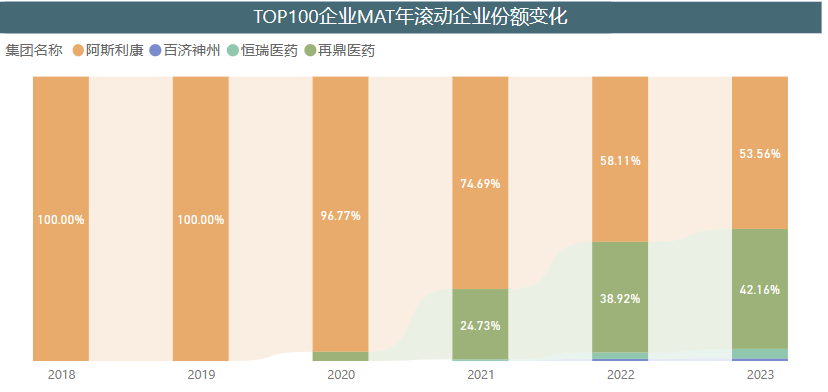 来源:医药魔方PharmaBI数据库 来源:医药魔方PharmaBI数据库
继2023年5月齐鲁获得该药品首仿后,科伦药业的产品也于近日获得了上市许可。根据医药魔方NextPat数据库,阿斯利康在中国专利平台登记了奥希替尼多项专利,其中化合物专利到期时间为2024年3月12日。而齐鲁和科伦以及多家企业针对其核心化合物专利均进行了3类声明。这也就意味着,这些仿制药在2024年3月之前,均不会将仿制药推向市场。
5. 阿普米司特片
原研企业:安进
首仿企业:石药集团
中国核心专利到期时间:2023年3月20日
全球销售峰值:尚未达销售峰值,2022年为22.88亿美元
阿普米司特片(欧泰乐®)是新基研发的一款新型口服、小分子磷酸二酯酶4(PDE-4)抑制剂,2014年获FDA批准上市,用于治疗斑块状银屑病。2019年8月26日,安进与新基达成协议,以134亿美元现金的价格收购该药物的全球权益。2022年Otezla(阿普米司特海外商品名)全球销售额达22.88亿美元。
阿普米司特片于2021年8月12日获NMPA批准上市,时隔不到两年,石药集团便于2023年3月拿下首仿资格,获NMPA批准上市,紧随其后的是齐鲁制药。截至目前,国内已有11家企业的阿普米司特片仿制药在国内获批上市,竞争情况可谓激烈。
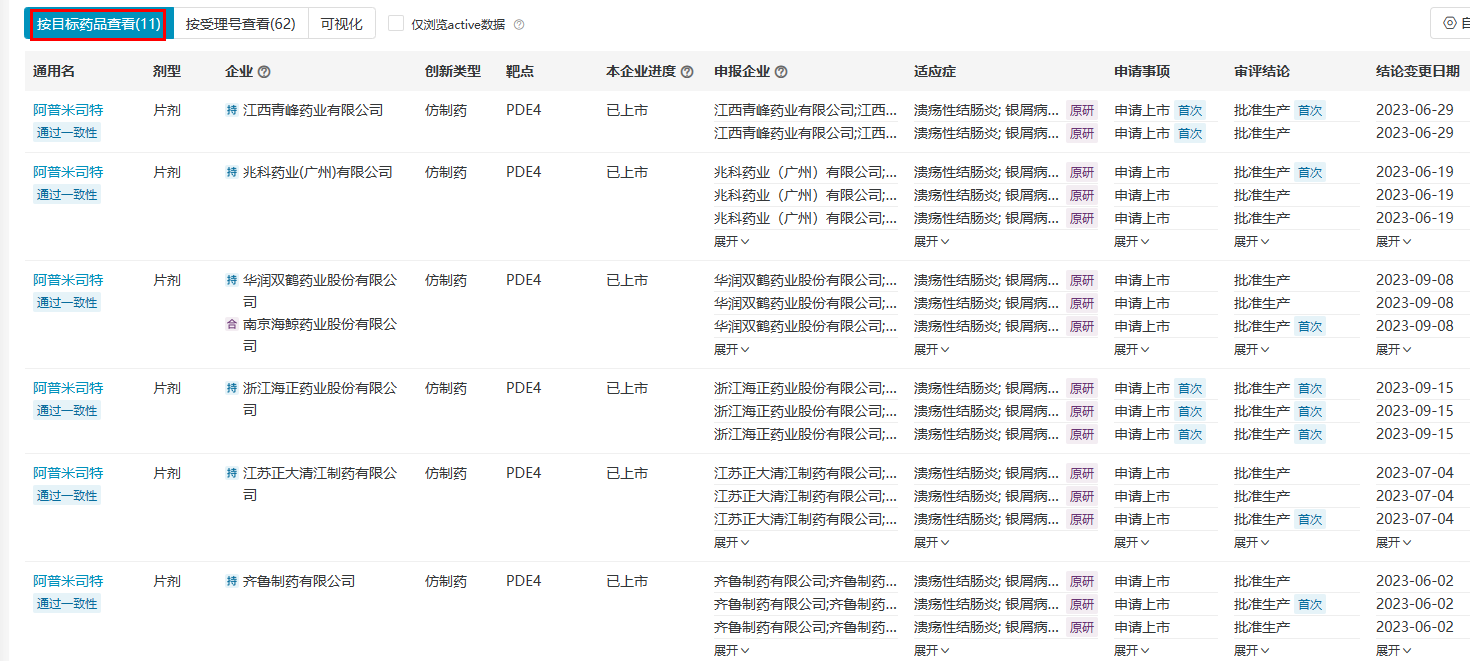 来源:医药魔方PharmaGO数据库 来源:医药魔方PharmaGO数据库
根据医药魔方NextPat数据库,阿普米司特片在中国的化合物专利已于2023年3月20日到期,目前石药集团和齐鲁制药的仿制药均已开售。3家企业产品中国医院终端前三季度总销售额超过1000万元。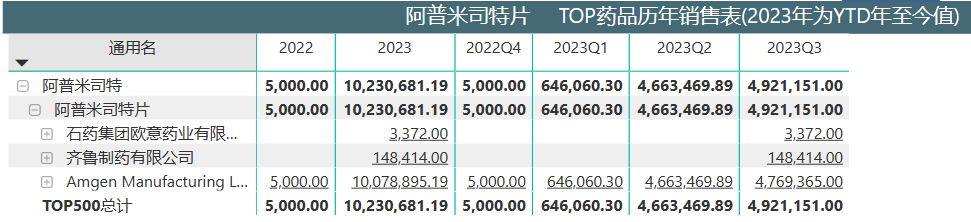 来源:医药魔方PharmaBI数据库 来源:医药魔方PharmaBI数据库
不过,因2021年9月安进在一项关于其与Sandoz和Zydus针对Otezla的专利纠纷中胜诉。使得该药物美国保护期延长至2028年2月,成功阻止仿制药商在此专利期满之前在美国售卖Otezla仿制药。
来源:医药魔方NextPat数据库
6. 多替拉韦钠片
原研企业:GSK
首仿企业:齐鲁制药
中国核心专利到期时间:2026年4月28日
全球销售峰值:22亿美元(2018年)
原研产品多替拉韦钠片是葛兰素史克(GSK)旗下ViiV Healthcare研发的一款HIV整合酶抑制剂,可以通过阻止病毒DNA整合至人体免疫细胞的遗传物质来阻断HIV的复制。该产品于2013年8月率先在美国上市,2018年,其销售额达到22亿美元的销售峰值。随着市场上多款HIV长效疗法获批,其近几年销售额呈逐渐下滑趋势。
多替拉韦钠片原研药特威凯®于2015年12月进入中国市场,2022年中国医院终端总销售额达2000万元。其在国内的化合物专利将于2026年4月28日到期,目前国内仅齐鲁制药的仿制药在国内获批上市,尚无仿制药开展BE或申报上市。
根据根据医药魔方NextPat数据库,齐鲁制药共登记了两个专利声明,其中化合物专利为3类声明,药物组合物专利为2类声明,也就意味着,齐鲁制药需要在化合物专利到期后,销售其仿制药。
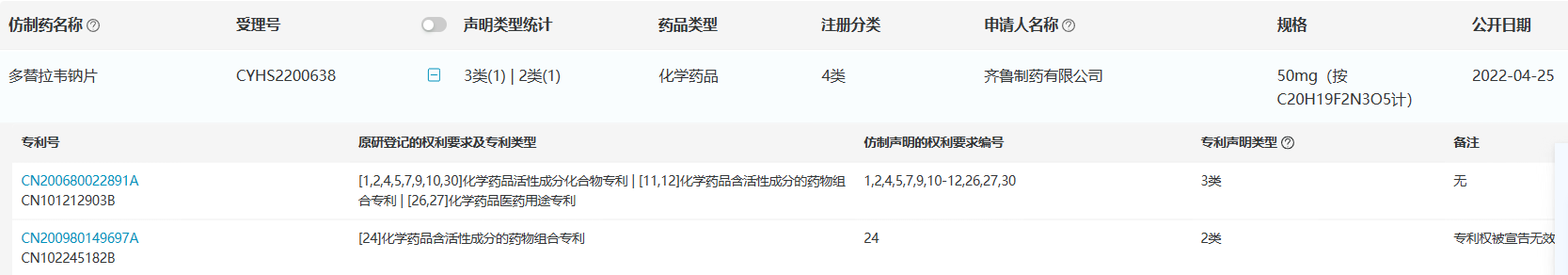 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
7. 盐酸尼洛替尼胶囊
原研企业:诺华
首仿企业:特瑞药业
中国核心专利到期时间:2023年7月4日
全球销售峰值:20.6亿美元(2021年)
尼洛替尼是为新一代TKI抑制剂,可有效用于对伊马替尼产生耐药的或不耐受的慢性髓性白血病患者的治疗。尼洛替尼作为用于CML-CP患者治疗的第二代TKI,在治疗效果上显著优于一代TKI伊马替尼,已成为治疗慢性髓性白血病患者的一线用药,同时可用于治疗2岁以上儿童慢性粒细胞白血病。
尼洛替尼(达希纳®)于2007年10月获FDA批准上市,2009年7月进入了中国市场,其优异的治疗效果和市场表现引起了国内仿制药企的重点关注,多家企业争相仿制。
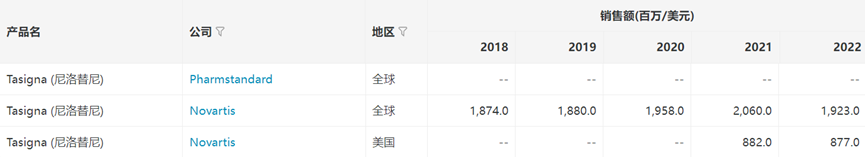 来源:医药魔方NextPharma数据库 来源:医药魔方NextPharma数据库
通过魔方PharmaGO数据库查询可知,苏州特瑞药业夺得该药品首仿资格,齐鲁制药的仿制药也已获批上市,江苏豪森、四川迪菲特药业、先声药业也已提交了上市申请。
尼洛替尼国内的化合物专利已经于2023年7月到期失效。此前,苏州特瑞药业针对尼洛替尼的关键专利CN200680026444.6(保护了尼洛替尼的药用盐化合物)和CN201080051819.0(保护了尼洛替尼的上市适应症)发起了专利无效挑战,均已成功。近日,尼洛替尼的一篇晶型专利CN200680026434.2也被宣告全部无效。意味着尼洛替尼对国内仿制药造成较大阻碍的关键专利障碍均被解除。
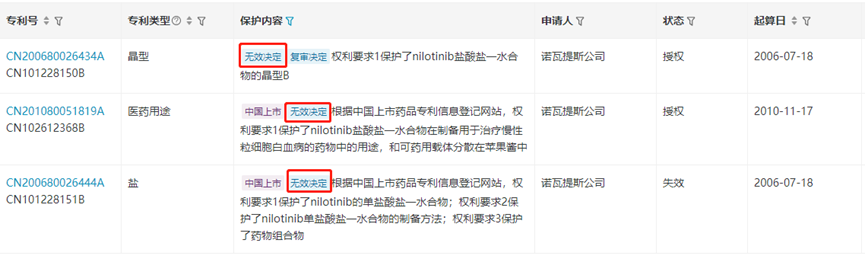 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
8. 马昔腾坦片
原研企业:Actelion(被强生收购)
首仿企业:普济生物、杭州中美华东、南京正大天晴
中国核心专利到期时间:2021年12月4日
全球销售峰值:18.19亿美元(2021年)
马昔腾坦是一种内皮素受体拮抗剂,该药最早由Actelion Pharmaceuticals研发,于2013年获FDA批准上市,是首个获批用于肺动脉高压的口服制剂。2017年,强生收购Actelion。同年,马昔腾坦原研(傲朴舒®)在中国获批上市,用于治疗肺动脉高压,以延缓疾病进展。2021年,马昔腾坦原研的全球销售额为18.19亿美元。
2023年10月,杭州中美华东、南京正大天晴和普济生物的马昔腾坦片获批上市,3家共同斩获马昔腾坦片首仿。目前还有齐鲁制药、华铂凯盛生物、旭东海普药业等5家企业提交了该产品仿制药上市申请。
根据医药魔方NextPat数据库,马昔腾坦的化合物专利已于2021年底失效,其制剂专利已有多家企业做了4.2类声明,称仿制药规避了原研制剂专利。也就意味着,已获批的仿制药可以直接上市销售。
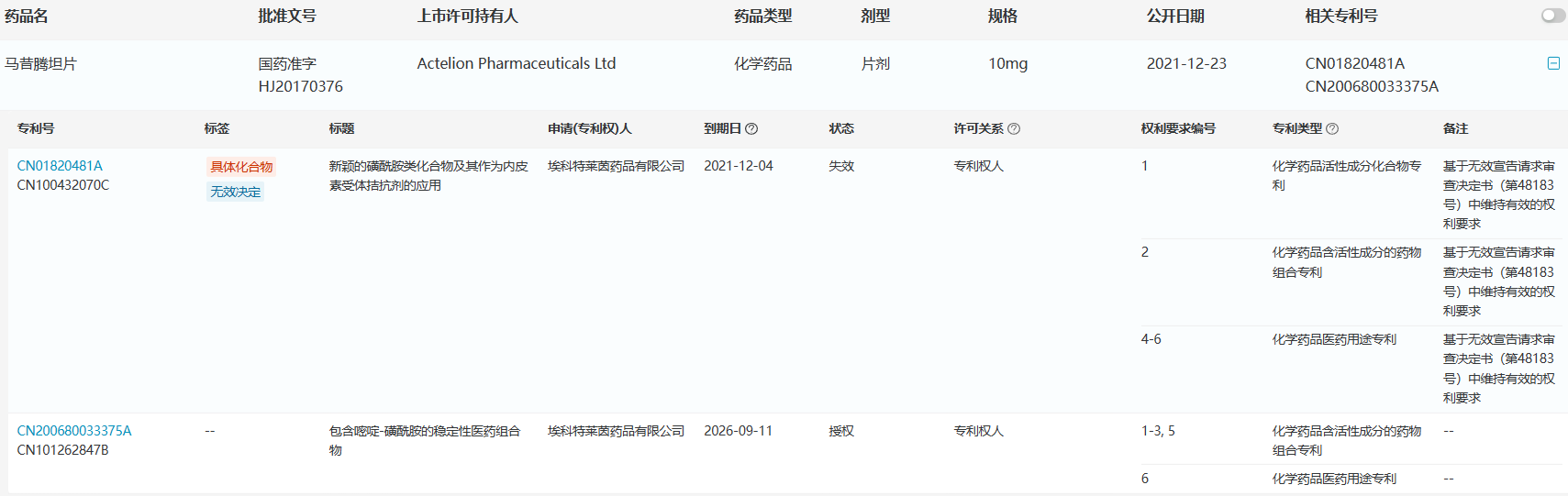 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
9. 洛匹那韦利托那韦片
原研企业:艾伯维
首仿企业:迪赛诺医药
中国核心专利到期时间:2016年12月6日
全球销售峰值:不详,可追溯最高年销售额为13.67亿美元(2009年)
洛匹那韦利托那韦片(克力芝®)原研企业为艾伯维,该药品曾于2000年9月获FDA批准上市,并于2002年在中国获批。目前获批适应症为:与其它抗反转录病毒药物联合用药,治疗成人和2岁以上儿童的HIV-1感染。是国家免费的艾滋病抗病毒药物。
原研产品曾达到超10亿美元销售峰值,不过随着专利悬崖到来,收到仿制药的冲击市,其销售额近些年呈下滑趋势,2022年的全球销售额仅为2.83亿美元。
不过在中国,迪赛诺医药的仿制药于2023年3月10日获NMPA批准上市,成为该品种的首仿,紧随其后,贝克生物的仿制药也于同年10月获NMPA批准。
根据医药魔方NextPat数据库,洛匹那韦利托那韦片的化合物专利已于2016年12月6日到期,尚无其他相关专利,迪赛诺医药和贝克生物登记的专利声明均为1类(登记平台中没有被仿制药品相关专利信息)。
10. 巴瑞替尼片
原研企业:Incyte
首仿企业:南京力博维制药
中国核心专利到期时间:2029年3月10日
全球销售峰值:11.15亿美元(2021年)
巴瑞替尼是一款每日口服一次的JAK抑制剂,最初由Incyte开发。2009年12月,礼来与Incyte达成协议,合作开发和商业化该产品。截至目前,FDA已批准巴瑞替尼片用于治疗类风湿性关节炎、特应性皮炎、新冠病毒感染、斑秃等4项适应症。该药物也是全球首个获批治疗重症斑秃的JAK抑制剂,2021年全球销售额达11.15亿美元。
巴瑞替尼片原研产品(艾乐明®)于2019年6月在国内获批上市,用于治疗类风湿性关节炎,2023年3月在国内获批用于成人患者重度斑秃的治疗。
目前,南京力博维制药/南京优科制药合作申报的巴瑞替尼片已于2023年9月成功取得了首仿资格获批上市,山东华铂凯盛/安徽泰恩康制药合作申报的仿制药正在申请上市中。另外还有数家仿制药已经在进行生物等效性试验。
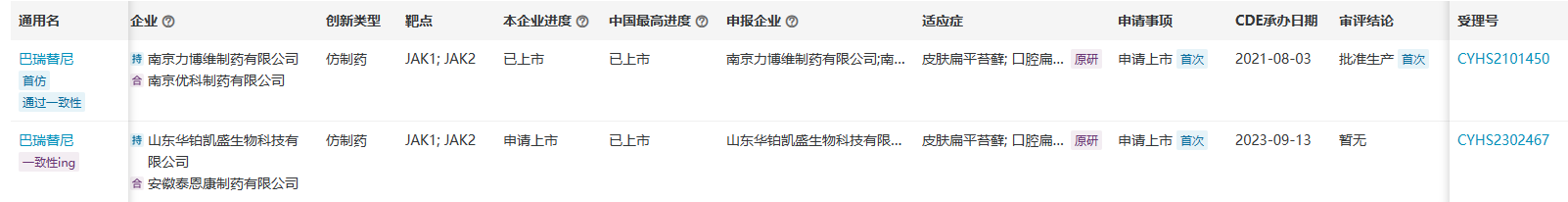 来源:医药魔方PharmaGO数据库 来源:医药魔方PharmaGO数据库
上述两家进行仿制药申报上市时均提交了较为保守的3类声明,并没有对上述巴瑞替尼的化合物专利发起4类声明进行专利挑战。
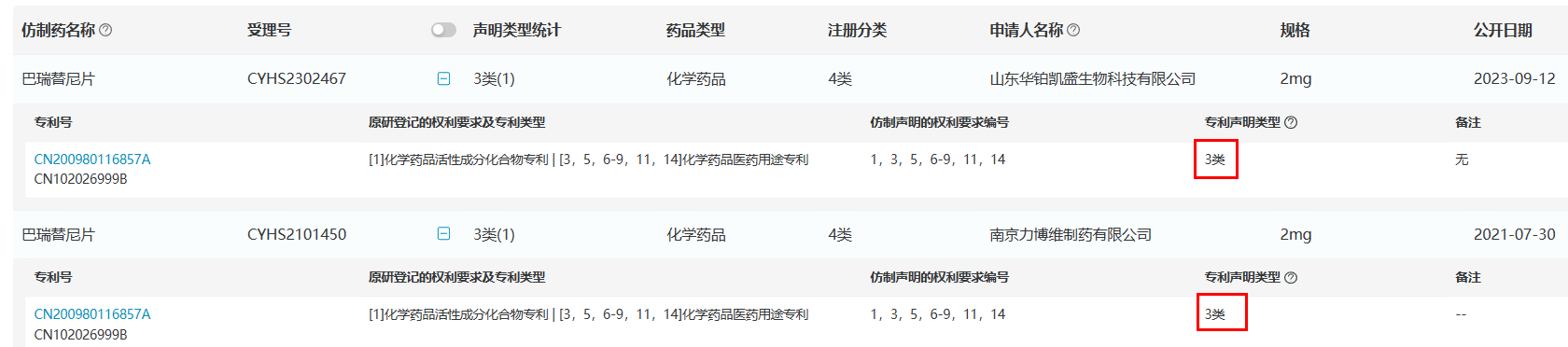 来源:医药魔方NextPat数据库 来源:医药魔方NextPat数据库
不过近日,国知局针对Incyte的一篇化合物专利CN200980116857.7发出无效宣告请求审查决定书,宣告专利权全部无效。无效宣告请求人为南京斯帕克医药科技有限公司(推荐阅读:重磅斑秃新药「巴瑞替尼」化合物专利被宣告全部无效)。
来源:医药魔方NextPat数据库
总结
通过对以上10款重磅首仿药的专利情况和竞争格局情况进行分析后,我们也可以得知,随着专利链接制度的正式实施,首仿药能否即刻进入市场,还需要考虑原研产品在中国的专利布局情况。除非是核心专利被无效、到期或者是获得了原研的许可(例如:富马酸奥赛利定 、恩那度司他、氟[¹⁸F]贝他苯),才可以将仿制药推向市场,否则可能面临专利纠纷。
|