|
经历了FDA的严格认证,一批新兴的中国药企正在从临床走向商业化,真正闯入海外市场。
3月15日,百济神州宣布,FDA已批准百济神州PD-1抑制剂替雷利珠单抗上市,用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。

继君实生物的特瑞普利单抗开创先河,成为首个赢得FDA青睐的中国PD-1抑制剂,替雷利珠单抗的批准不仅是对中国生物医药创新实力的再次肯定,也是对百济神州全球影响力的进一步扩展。
事实上,中国药企的创新实力正在得到越来越多地关注。3月12日,贝达药业控股子公司Xcovery收到FDA的受理信,公司提交的盐酸恩沙替尼(以下简称“恩沙替尼”),拟用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗的(即一线适应症)的上市许可申请(NDA)获得了FDA正式受理,标志着恩沙替尼海外上市的重要一步。
恩沙替尼有望成为首个由中国企业主导在全球上市的肺癌靶向创新药,这是贝达药业在2021年12月在美国成功申报首个IND后,再一次往国际化迈出的重要一步。
业内人士分析,随着中国医药市场的不断扩大和医疗水平的提升,中国创新药在国际市场上的话语权将逐渐增强。同时,中国在生物技术、基因工程等领域的研发能力也在不断提升,为中国创新药在国际市场上的竞争力奠定了坚实的基础。
从量变到质变
多款国产药收获FDA新进展
近年来,FDA持续加强对药品的安全性和有效性进行严格审查,并实施了一系列措施来确保药品的质量和监管。这些措施包括加强对药品的审批、监督和检查,以及对不合格药品的处罚和召回等。
曾经,多个国产新药闯关FDA受挫,这说明了中国创新药出海之路绝非坦途,需要在研发申报能力、并购整合能力、质量管控能力、临床数据质量管理上与国际标准全面接轨。
如今,除了贝达药业的恩沙替尼、百济神州的替雷利珠单抗,据《医药经济报》不完全统计,近半年来,至少有20家国内药企成功在FDA取得新进展(包括临床试验批准、快速通道资格认证、上市批准等)。
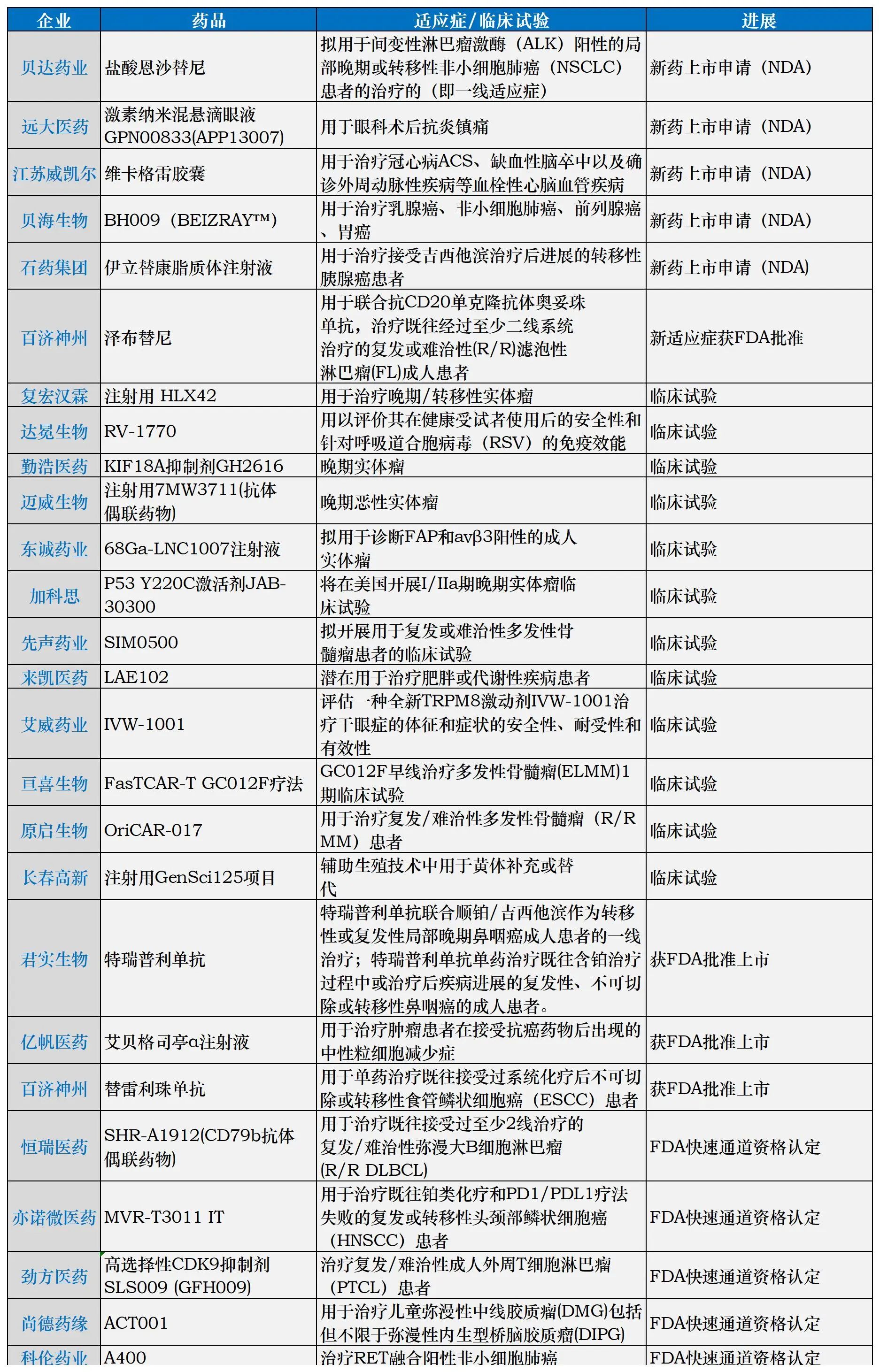
近半年国内部分药企在FDA取得创新药进展
从2024年以来闯关FDA的国产药来看,肿瘤药仍是业内关注的焦点。今年以来,包括科伦药业控股子公司科伦博泰主要产品A400、汇宇制药的多西他赛注射液、先声药业自主研发的抗肿瘤新药SIM0500等肿瘤药物均在美获得了一定的进展。
今年3月份,科伦药业发布公告,子公司科伦博泰主要产品A400(EP0031)获美国食品药品监督管理局授予快速通道资格认定。A400(EP0031)是第二代选择性RET抑制剂(SRI),对常见的RET基因融合和突变具有广泛活性,科伦博泰于2021年3月从Ellipses Pharma Limited获得授予一项在大中华区、朝鲜、韩国、新加坡、马来西亚及泰国之外的所有国家开发、制造及商业化A400(EP0031)的独家、付特许权使用费、可转授的许可。
同样在3月份,先声药业发布公告,公司自主研发的抗肿瘤新药人源化GPRC5D-BCMA-CD3三特异性抗体SIM0500新药临床试验申请(IND)获美国食品药品监督管理局(FDA)批准,拟开展SIM0500用于复发或难治性多发性骨髓瘤患者的临床试验。此外,SIM0500中国IND申请已于2024年1月2日获得中国国家药品监督管理局受理。SIM0500是一种人源性GPRC5D-BCMA-CD3三特异性抗体,基于临床前数据其是治疗多发性骨髓瘤的潜在同类最佳(BIC)药物。
除了始终保持在高热度的肿瘤药,还有部分前沿风口领域的药品也在FDA申报方面实现新突破。
以辅助生殖领域为例,今年1月,长春高新宣布,控股子公司金赛药业注射用GenSci125项目将在美国开展I期临床试验。从此前发布的公告信息资料来看,该药物的适应症为辅助生殖技术中的黄体补充或替代,而黄体酮是临床维持妊娠常用且必需的药物。金赛药业方面表示,注射用GenSci125为公司自主研发,是FDA准予临床研究的首家注射用长效黄体酮周制剂。
核药作为日渐爆发的另一风口,也愈发受国内外药企的青睐。东诚药业公司下属公司蓝纳成新加坡收到FDA核准签发的关于68Ga-LNC1007注射液的药品临床试验批准通知书,并将于近期开展I期临床试验。东诚药业表示,68Ga-LNC1007注射液在肺癌、乳腺癌、肾细胞癌、食管癌、胰腺癌、卵巢癌等肿瘤中可能具有更好的肿瘤成像能力,有希望在未来临床中用于多种实体肿瘤的诊断。
业内观点认为,中国药企“出海”正在走过“量变”向“质变”升级的关键阶段,部分新药已经开始展现出更突出的临床获益潜力,国产新药BD出海和海外获批上市陆续兑现。从研发设计、临床、注册、生产到商业化等方面,这几款产品都能为当下焦灼于“出海”的创新药企提供一些经验,也为国内药企“出海”打开新局面。
已上市药物获益可观
国际化进程加速
发达国家更为广阔的市场规模、中国药企出海竞争力的提升以及海外收入逐步进入稳定增长通道等因素驱动着药企选择出海。而从适应症到销售额,以及到专利诉讼,出海的创新药企们正在逐步成长起来:
百济神州的BTK抑制剂百悦泽(泽布替尼)全球年销售额首次突破十亿美元大关,2023年达13亿美元,成为国内首个“十亿美元分子”。3月8日,百济神州宣布在美国新泽西州联邦法院分别对山德士以及 MSN Pharmaceuticals提起专利侵权诉讼,对两家公司通知百济神州递交泽布替尼仿制药上市申请做出回应。
此外,传奇生物的CAR-T产品CARVYKTI(西达基奥仑赛,cilta-cel)在商业化的第一年就实现了高达5亿美元的全球销售额。值得一提的是,3月15日,美国FDA的肿瘤药物顾问委员会(ODAC)对CARVYKTI用于相对前线治疗复发/难治性多发性骨髓瘤(R/R MM)的补充生物制剂许可申请(sBLA)进行了讨论。11位专家全票支持CARVYKTI拟议适应症的风险-获益评估结果良好。这次 ODAC 的讨论意见将帮助美国 FDA 决定是否批准CARVYKTI作为二线多发性骨髓瘤的治疗产品。
不仅创新药出海屡传捷报,中国作为仿制药大国,国内药企高水平制剂国际化也一直步履坚定,尤其在国内开始实施一致性评价和集采后,中国仿制药“出海”欧美市场进一步加速。
2022年,我国共有18家企业获得美国FDA的73个ANDA批文(62个品种)。华海药业是当年获得ANDA批文数量最多的中国企业。排名第二和第三的分别是复星医药和健友股份,3家企业占比超过总量的一半。据2022年年报,华海药业当年获得美国ANDA文号24个(包括5个暂时性批准),完成新产品申报10个。
据中国医药企业管理协会发布的《2023 年医药工业运行情况》,在仿制药方面,2023年我国共有24家企业获得美国FDA的67件ANDA批文(59个品种),产品剂型以注射剂为主;获得ANDA批文数量前三位的企业分别是复星医药、普利制药和健友股份。
据BCG(波士顿咨询)分析,国际领先药企海外收入平均占比都超过60%。而我国海外收入占比最高的综合药企为复星医药,其海外收入占总营收的比例达到35%(还包括海外收购带来的现金流及新冠疫苗的海外销售)。
此外,在美国市场,争取最好的价格是大部分仿制药企实现利润最大化的常见做法。以宣泰医药为例,其核心业务便是将首仿药卖到美国市场:一款仿制药泊沙康唑年收入2.5亿元,为公司贡献近80%收入。2020年,公司整体收入达3.19亿元,净利润率在40%左右。得益于泊沙康唑,宣泰医药计划以60亿元估值登陆科创板,引发资本市场关注。
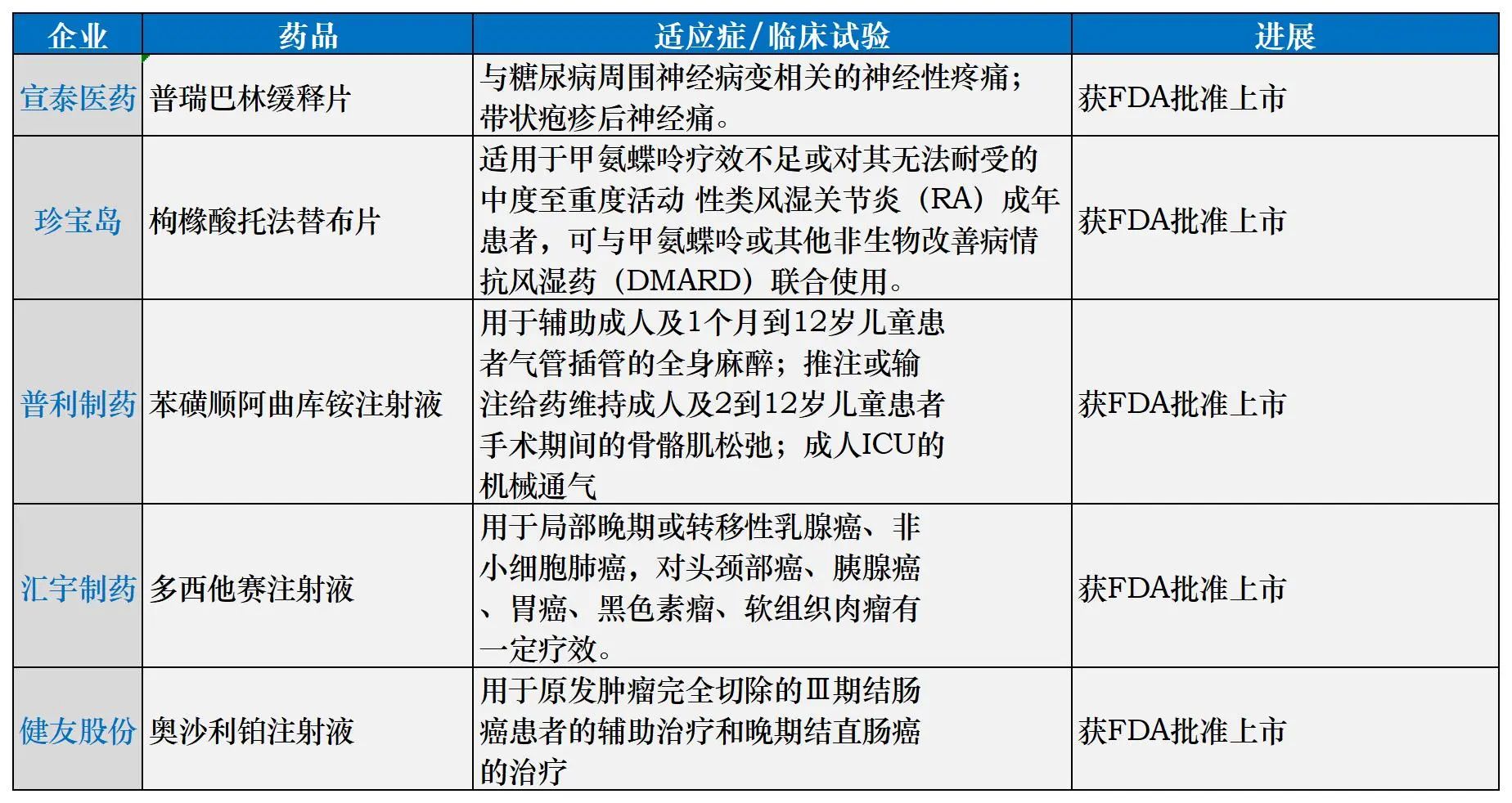
近半年国内部分药企在FDA取得ANDA进展
出海是机遇也是挑战。海外药品价格的确有更为明显的价格溢价空间和强大的市场吸引力,而想要真正闯入海外市场也绝非易事。市场观点指出,“出海”意味着进入全球竞争,技术壁垒是主要的竞争利器,而药物试验和临床数据等需要经FDA等权威机构的审查和批准,出海“征途”道阻且长。
|