|
CFDA 11月23日公布了2016年10月份批准上市的药品。共22件。其中国产化学药品14件,生物制品2件;进口化学药品2件,生物制品4件;(品种目录见附件)。
2016年10月份已批准药品上市品种目录
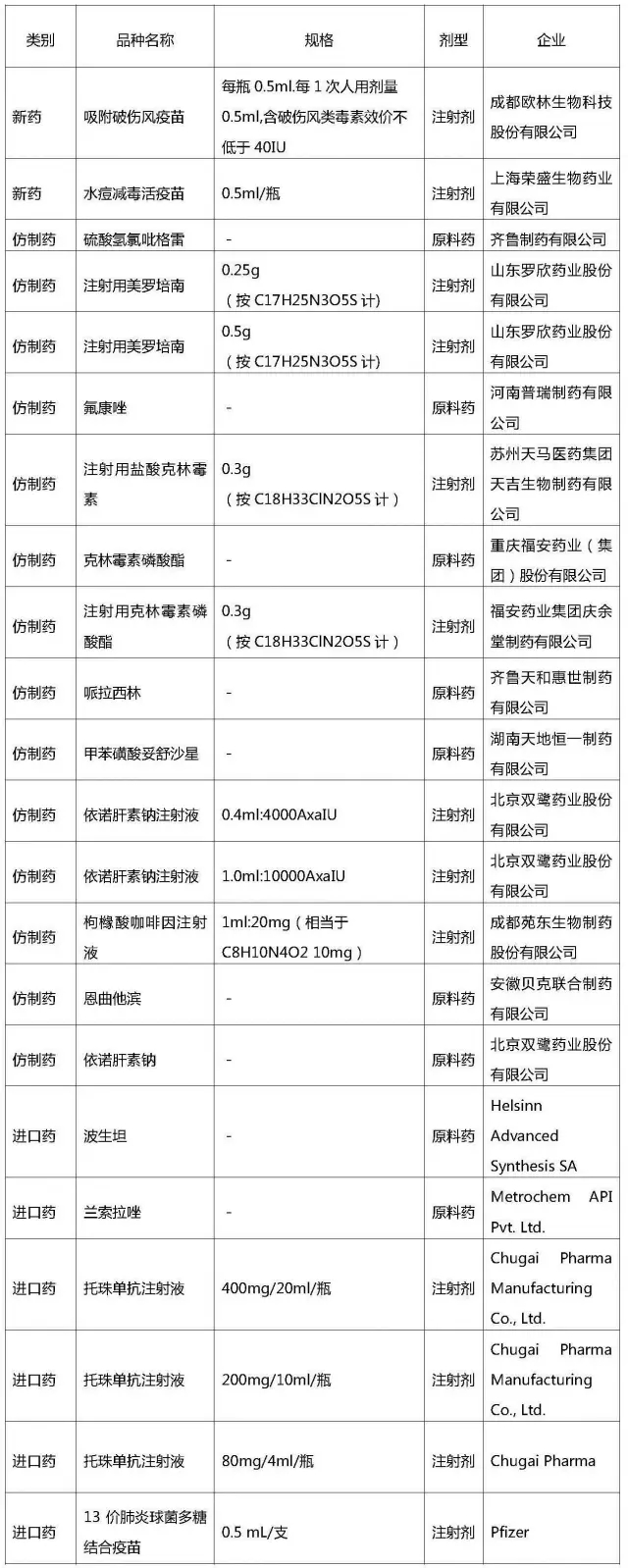
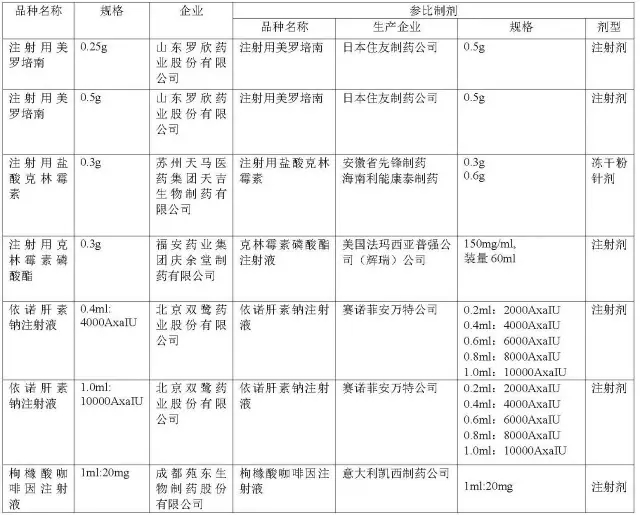
此次药品批准上市公告与之前最大的不同是,CFDA首次将仿制药的参比制剂信息一并列出,并明确注明苏州天马医药集团的“注射用盐酸克林霉素”这个品种在批准上市3年内需按照国发[2015]44号文件规定进行质量和疗效一致性评价。
10月份部分上市药品的参比制剂信息
CFDA 11月22日在网站上发布了关于“一致性评价政策工作问答”,其中就提到了这个新上市仿制药的一致性评价问题:
问:按新注册分类后批准的仿制药和新注册分类申报批准上市的仿制药是否都视为通过一致性评价。
答:根据总局2015年第230号文规定,新注册分类实施后申报并批准上市的仿制药将,按与原研药质量和疗效一致的原则进行受理和审评审批。新注册分类实施前受理并在实施后批准的仿制药,如企业选择按原规定进行审评审批,则需在药品批准上市3年内需按照国发〔2015〕44号文件规定进行质量和疗效一致性评价。
可以概括为以下两点:
-
新化药注册分类实施后的仿制药申报,国家局会按“与原研药一致”的高标准进行审评审批。
-
新化药注册分类实施前的仿制药申报,如果企业选择按旧标准审评,国家批上市没问题,但企业要在3年内完成一致性评价。
至此,监管层对一致性评价的政策已经很清晰了,药企没有借口,没有退路(见:一致性评价15个焦点政策问题,请读懂官方潜台词!)。
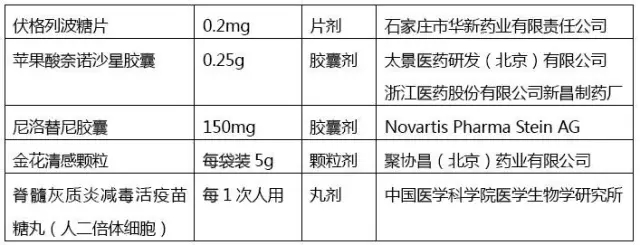
截至目前,CFDA在2016年共发布了9张药品批准上市公告(8月份的批准上市药品清单未发布)。汇总后我们可以发现,,口服固体制剂的批准数量非常非常少,今年到目前为止也仅仅批准了5个,见下表:
|