3月20日,国家食品药品监督管理总局发布了仿制药参比制剂目录(第二批)的通告,其在公告中称,经CFDA仿制药质量与疗效一致性评价专家委员会审核确定,发布仿制药参比制剂目录第二批。这与第一批51个参比制剂目录出炉只差了3天,此次目录共涉及33个品种。
从目录来看,此次发布的品种中,有诸多是仿制药药大品种,例如阿卡波糖片,据华东医药发布最新的年报显示,其该产品已经超过了15亿元的销售大关;氯吡格雷片的参比制剂也定了,参照的是原研进口,国内最大仿制厂家是信立泰,其产品年销售也超过了20亿元,在仿制药一致性评价刚开始时,其还希望自证参比制剂。
第一批参比制剂目录和第二批参比制剂目录加起来,已经有84个品种了,而且从发布频率来看,参比制剂的问题将不再是困扰仿制药一致性评价的问题了。那么,除了此前所说的参比制剂目录问题之外,仿制药一致性评价还差什么?
第二批参比制剂目录
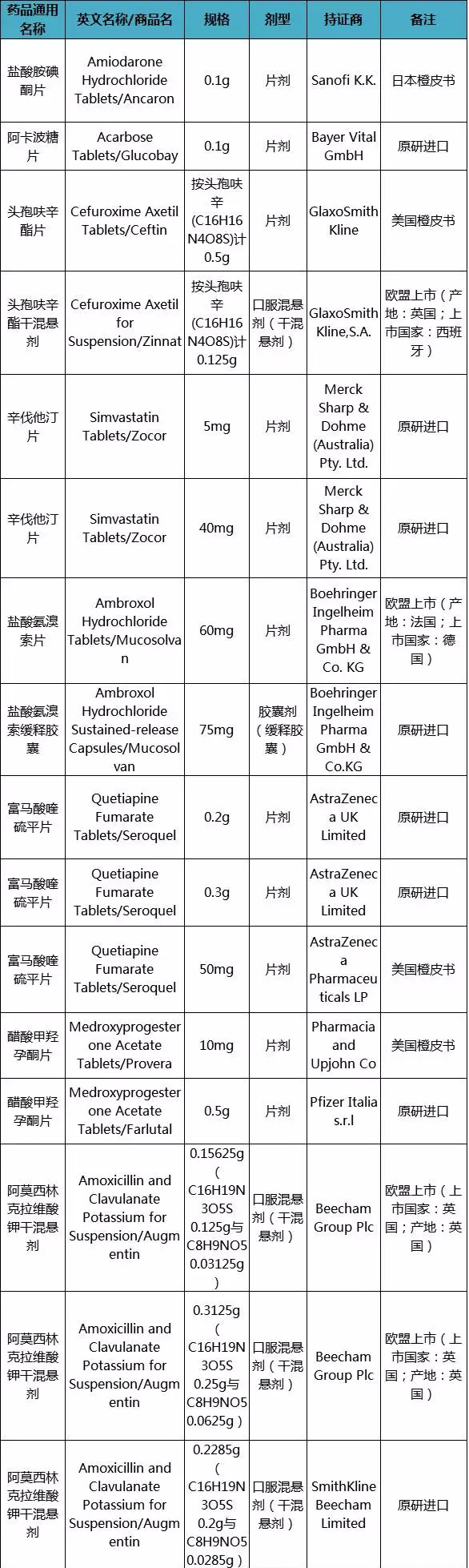 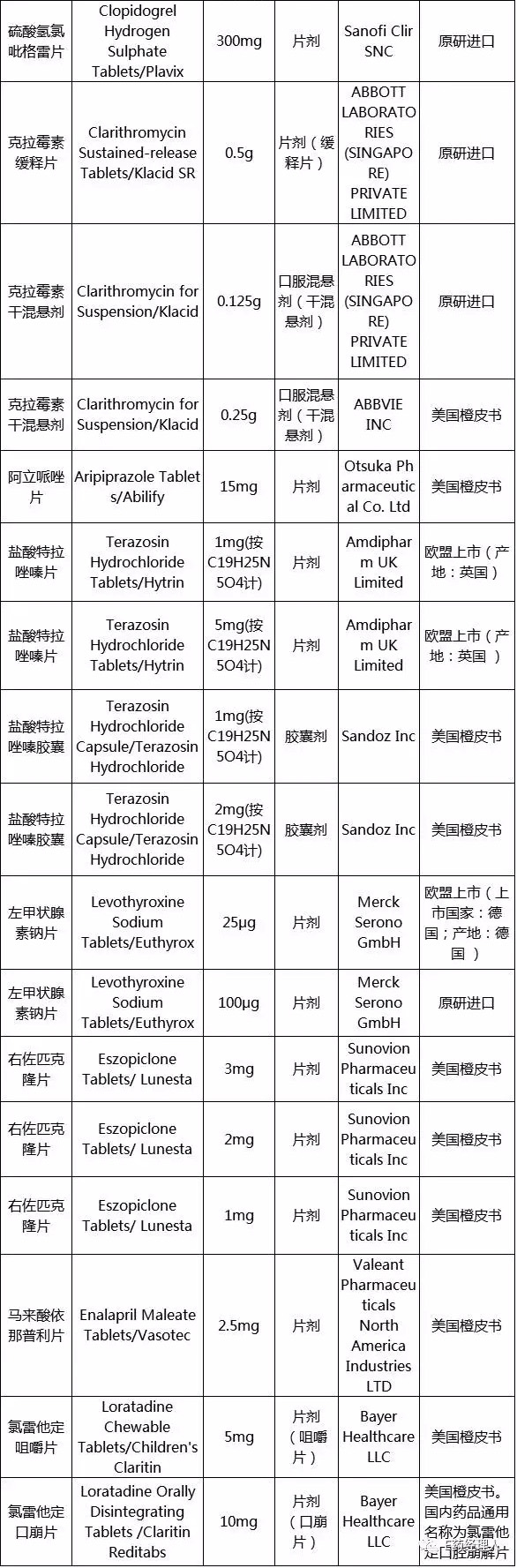
来源:CFDA官网
当然,需要提醒的是,第二批参比制剂出炉,企业应该更多地关注在对原研药的深入认知和工艺、关键辅料等研究上,而不是思考自己的资料能否符合监管部门的要求。
1
放开,也抢不到临床基地
除了参比制剂目录的限制之外,另一大问题便是临床试验基地严重匮乏的现状。有数据显示,目前国内能够承接生物等效性试验的医疗机构有103家,其中有意愿承接项目的仅有53家,且每家机构一年能完成的临床试验只有10项左右。尤其是7~22临床自查核查工作开展以来,一些大型三甲医院不愿意承接生物等效型试验项目,使得原本数量并不多的状况雪上加霜。
“进入2017年,BE资源明显更加紧张。药企抢临床试验基地的情况也更加严峻。”国内一家药企的副总告诉E药经理人。刚刚发布的<关于进一步改革完善药品生产流通使用政策的若干意见>已经明确提出:“允许具备条件的医疗机构、高等院校、科研机构和其他社会办检验检测机构等依法开展一致性评价生物等效性试验,实施办法另行制定。”这意味着,企业开展一致性评价过程中,生物等效性试验将不再局限于有GCP资质的医疗机构,其他有条件的社会机构也可以参与进来。
多位企业研发负责人认为,一旦政策落实,其他有条件和资质的医院和CRO机构等均可以开展相关工作,预计2017年研发资源匮乏的现状可以得到缓解。据了解,目前国内已经有个别大医院联合小医院合作开展相关工作。
担忧同样存在:新开的基地企业其实一时也不敢去用。“生物等效试验技术含量并不高,核心仍然是规范性问题。国内目前最大的问题是方法学上的化学验证,这决定着试验的成败。”前述药监人士建议,生物等效性试验放开之后,监管部门也不能放手不管,需加强事中和事后的监管。
与此同时,很多企业对于品种的筛选工作也已经告一段落。日前江苏省食药监局集中公开公布了一批34家药企的270个品种寻求一致性评价外部合作。如江苏吉贝尔药业有30多个文号在寻求外部合作。这些品种均在289目录中,可见有心无力的药企们正在为那些“非核心”品种寻找出路。
“品种多,研发资金和研发资源匮乏,企业也做不过来,有些或与企业未来的产品规划不匹配,或多年不生产,或市场份额小的也会寻找外部合作。”某江苏省企业的研发负责人告诉E药经理人。
的确,临床资源的紧缺引发的临床试验费用的飙升使得企业开展评价工作的成本水涨船高,业内流传的数字是,BE临床试验费用在600万元左右。据调查,某家口服固体制剂批文较多的企业,预计今后3年一致性评价的投入在5亿元以上。而2015年全国化学制剂企业净利润600万元以下的占42.18%,一年的利润还不够一个品种的一致性评价投入。
前述药企副总认为,无论是参比制剂、临床试验资源的关键突破,还是企业目前的最新进展,2017年一定是一致性评价转折性的一年,在研发实力、研发资源和企业财力的大比拼中,这一年也势必会产生一批脱颖而出者。
2
落地?落地!
如今企业诉求比较强的是一致性评价整个工作沟通渠道的通畅和路径的全面打通。
一方面,企业在开展过程中遇到的疑难杂症,希望可以向监管部门寻求帮助。虽然仿制药一致性评价的一系列指导性文件都已经相继出台,但企业在开展工作的过程中对遇到的很多复杂问题仍然感到无措。
“我们希望规则问题上有更明确的方向,一些老品种尤其是改剂型、改规格和改盐基的产品,指导原则的表达很含糊,很多问题没有办法下判断。”这是另一家药企研发负责人最大的诉求。该企业的一个重点品种,虽占据着40%~50%的市场份额,但由于无法决策,目前只能干等着。
可见,很多具体的技术和细节判断问题也是药企在一些品种上无法决策无法向前推进的原因之一。比如,一般来讲,企业都是先做药学研究,在药学一致的基础上做生物等效,但企业逐渐发现有些品种曲线一致生物等效却不一致,也有曲线不一致但生物等效一致。这也不断颠覆着企业的认知。
对此,某行业观察者的观点是:一方面,过去国人习惯了对政府和监管部门出台法律法规寄予厚望,习惯了听从政策的指挥棒。“一些人应该更多地关注在对原研药的深入认知和工艺、关键辅料等研究上,而不是思考自己的资料能否符合监管部门的要求。”
另一方面,作为一致性评价办公室主力军的中国食品药品检定研究院(以下简称“中检院”),其技术水平、审批水平等各方面的工作能力直接关系到这项工作的推进速度。但是其目前与制药企业们紧锣密鼓的抢时间的状态相比,显得太过低调且封闭。
“对于很多复杂问题,中检院总体上给企业的感觉是作为不足,看起来只是收发文件;开放性太差,与企业、专家的沟通不足。这与其能力不足、一致性评价工作太复杂有关,而中检院过去并非以审评见长。”前述药监系统人士建议,中检院尤其一致性评价办公室需摒弃担忧,用开放的心态,与企业、专家和相关方不断讨论,才能有新的突破。
实际上,仿制药一致性评价工作放在任何一个部门都不会那么顺利,蹒跚学步中即便摔倒也正常。面对这项复杂的系统工程,国内没有成熟的实践经验。业内人士指出,尽管国家非常重视,但是在执行路径的顶层设计上还差太多,也是致使后来参比制剂、临床试验资源等等复杂问题不断出现的原因,如果这些工作做在前面,后期制药做好职能分工,就不会如此被动。
另一方面是评价工作完成之后,后续的申报、现场核查流程以及审批等通路问题。尽管一致性评价的工作程序已经出台,但目前为止,由于还没有企业申报,流程中具体的细节问题还没有定论。
前述药监人士的推断是,后续很大的可能性会是包括一致性评价办公室在内的监管机构以及官员将被企业带着往前走,即企业倒逼政府必须有所作为。无论是参比制剂还是其他问题,在目前还未有企业做出来的时候,政府不动还情有可原,等由企业完成了评价工作,政府势必要有所交代。
但据知情人士最新透露,对于一些参比制剂明确的品种,目前国内已经完成评价工作的企业已经有10家左右,只等CFDA能够落实相关申报审批。该人士认为,对于已经完成评价的品种,企业要早点申报;在保持标准一致的前提下,CFDA也要早点批,只有打通一条通路,并做好引导工作,才能彻底激发整个行业、让企业紧张,这对加速这项工作进展的作用将是巨大的。
本文版权属于E药脸谱网(www.y-lp.com)。
|