|
默克公司(纽约证券交易所股票代码:MRK),在美国和加拿大之外被称为MSD,今天宣布,基于KEYNOTE-189试验的结果,美国食品和药物管理局(FDA)批准了针对KEYTRUDA®(Merck的抗PD-1疗法)又一个适应症,即与培美曲塞(ALIMTA®)和铂类化疗联合用于转移性非鳞状非小细胞肺癌(NSCLC)患者的一线治疗,这些患者没有EGFR或ALK基因组肿瘤畸变。根据KEYNOTE-189的结果批准,其中KEYTRUDA联合培美曲塞和铂化疗,与单独化疗相比,死亡风险降低一半。
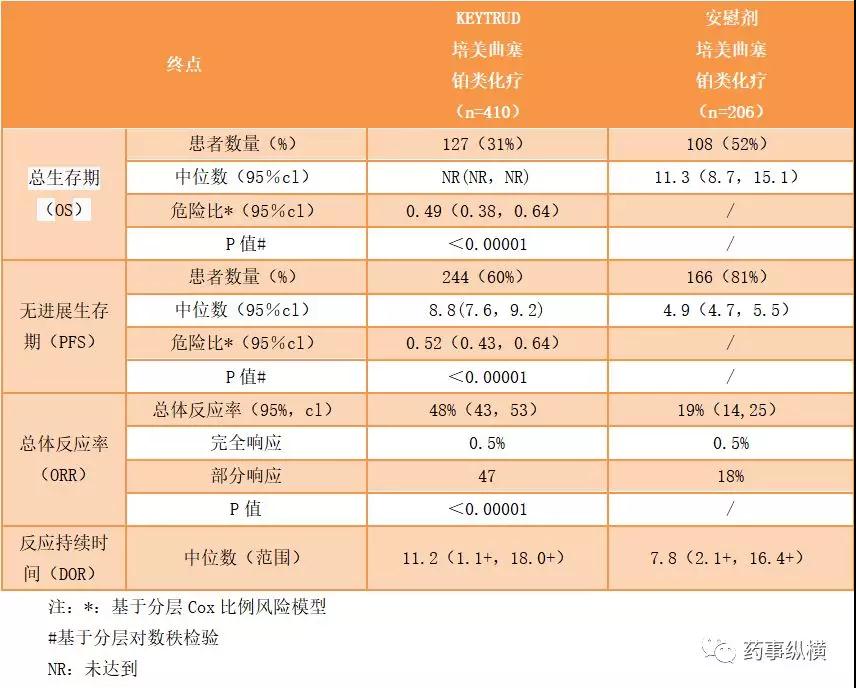
在关键的第3阶段KEYNOTE-189试验中,无论PD-L1肿瘤如何表达,KEYTRUDA联合培美曲塞和铂类化疗均显示出总生存期(OS)的统计学意义和临床意义上的改善(HR = 0.49 [95%] CI,0.38-0.64]; p <0.00001),与单独化疗相比,将死亡风险降低一半。该研究还表示,与单独化疗相比,无进展生存期(PFS)显著改善(HR = 0.52 [95%CI,0.43-0.64]; p <0.00001)。来自KEYNOTE-189的数据表示KEYTRUDA正在改变这些患者的生存期望。
KEYTRUDA可能发生免疫介导的不良反应,这可能是很严重的或致命的,包括肺炎,结肠炎,肝炎,内分泌疾病,肾炎,严重的皮肤反应,实体器官移植排斥和同种异体造血干细胞移植(HSCT)的并发症。 根据不良反应的严重程度,应禁止或停用KEYTRUDA,并在适当时给予皮质类固醇。 KEYTRUDA还可能导致严重或危及生命的输液相关反应。 根据其作用机制,KEYTRUDA在给孕妇服用时会造成胎儿伤害。
基于肿瘤反应率和2期研究的无进展生存数据(KEYNOTE- 021,队列G1),KEYTRUDA联合培美曲塞和卡铂于2017年首次通过FDA加速批准程序,用于转移性非鳞状NSCLC患者的一线治疗。根据加速批准程序,持续批准取决于对临床获益的验证和描述,现已在KEYNOTE-189中得到证实,并导致FDA将加速批准转为批准。 KEYTRUDA是第一个PD-1抗体在一线治疗中被批准用以组合疗法和单一疗法用于某些特定的转移性NSCLC患者(参见下面的KEYTRUDA指征)。
该批准是基于KEYNOTE-189的数据,这是一项3期,随机,多中心,双盲,主动对照试验,用于治疗转移性NSCLC患者的全身治疗,无论PD-L1肿瘤表达状态如何。自身免疫性疾病患者,治疗2年内需要全身治疗;需要免疫抑制的疾病;或者在前26周内接受超过30 Gy的胸部放射治疗的患者不可使用该治疗方案。患者随机接受KEYTRUDA 200 mg,顺铂或卡铂,培美曲塞静脉注射Q3W(每三周给药一次),进行 4个疗,然后KEYTRUDA 200 mg,最长24个月,培美曲塞Q3W(n = 410);或顺铂或卡铂和培美曲塞静脉注射Q3W,进行 4个疗程,然后培美曲塞Q3W(n = 206)。继续治疗直至疾病恶化或发生不可接受的毒性发硬。主要疗效结果以盲法独立评估中心(BICR)通过检查每个RECIST v1.1(修改为遵循最多10个靶病变和每个器官最多5个靶病变)的 OS和PFS来评估。次要疗效结果指标是总体反应率(ORR)和反应持续时间(DOR)。接受化疗和培美曲塞治疗疾病进展的患者可以接受KEYTRUDA作为单药治疗。 KEYNOTE-189研究是与培美曲塞(ALIMTA®)的制造商Eli Lilly and Company合作进行的。
在KEYNOTE-189实验中药效结果如下:]
在KEYNOTE-189中,对接受KEYTRUDA联合培美曲塞和铂类化疗的405名患者和接受安慰剂,培美曲塞和铂类化疗的202名患者的安全性进行了评估。在20%的患者中,KEYTRUDA因不良反应而停药。导致KEYTRUDA永久停药的最常见不良反应是肺炎(3%)和急性肾损伤(2%)。导致KEYTRUDA中断的不良反应发生在53%的患者中;导致KEYTRUDA中断的最常见不良反应或实验室异常(≥5%)为中性粒细胞减少症(13%),虚弱/疲劳(7%),贫血(7%)和血小板减少症(5%)。接受KEYTRUDA联合培美曲塞和铂类化疗的患者中至少20%发生任何等级的不良反应为恶心(56%),疲劳(56%),便秘(35%),腹泻(31%),食欲减退( 28%),皮疹(25%),呕吐(24%),咳嗽(21%),呼吸困难(21%)和发热(20%)。
在过去的几年中,我们已经看到了显著的临床进步和我们在治疗转移性非小细胞肺癌患者的道路上发生的巨大转变,”Thirish Gadgeel博士说,他是密歇根大学罗杰尔癌症中心胸部肿瘤学教授 “作为一名执业医师,我欢迎今天的新闻,因为在KEYNOTE-189试验里KEYTRUDA联合培美曲塞和铂类化疗与单纯化疗相比显著延长了患者的总生存期和无进展生存期。
“KEYTRUDA正在迅速成为转移性非小细胞肺癌患者的基础治疗,”默克研究实验室总裁Roger M. Perlmutter博士说。 “基于KEYNOTE-189试验数据,今天批准KEYTRUDA是一个重要的里程碑,并让我们对改善患者生存结果的信念更加坚定,并为更多肺癌患者提供了希望。”
|