|
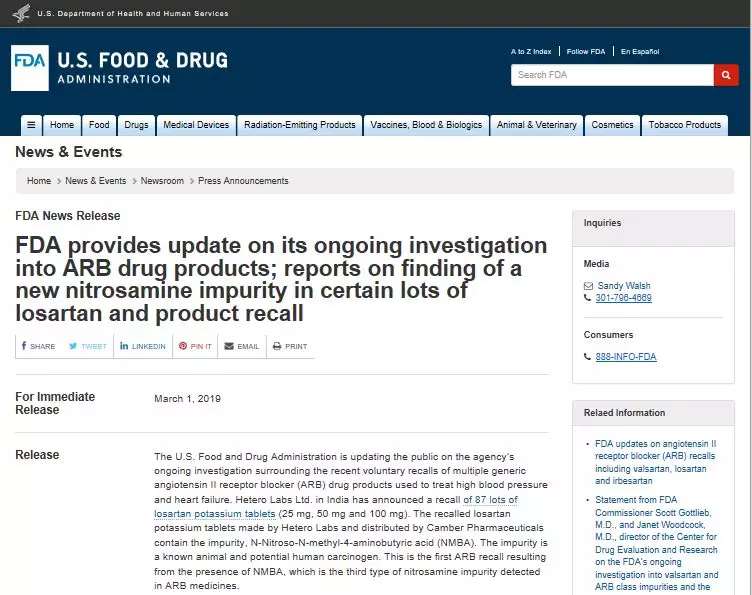
2019年3月1日,美国FDA在其官网上更新了缬沙坦致癌事件的最新调查报告,该调查涉及最近对用于治疗高血压和心力衰竭的多种通用血管紧张素II受体阻滞剂(ARB)药品的自愿召回。印度的HETERO LABS LTD. 宣布召回87批氯沙坦钾片(25毫克,50毫克和100毫克)。由HETERO LABS制造并由Camber Pharmaceuticals分销召回的氯沙坦钾片中含有杂质NMBA。

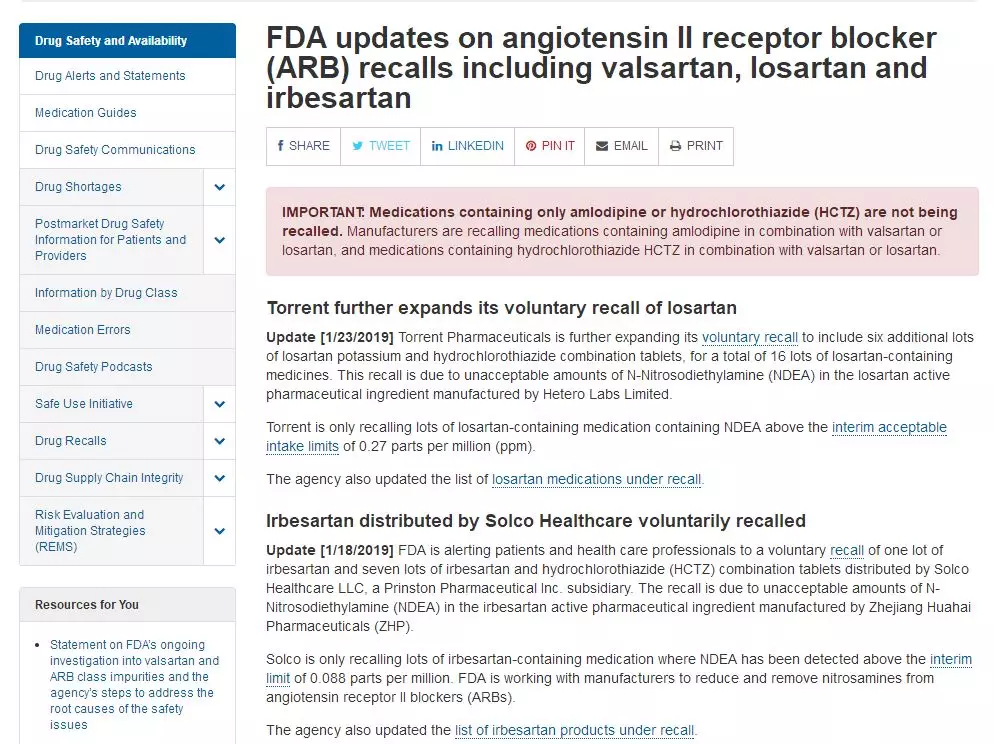
而在此之前,受原料药致癌事件影响,氯沙坦及厄贝沙坦多批次药物被相继召回。1月16日,我国药审中心就<关于在原料药工艺中生成亚硝胺类化合物的风险警示>公开征求意见文中明确提到,亚硝胺类化合物属于ICH M7指南中明确提出的具有较高致癌性(“关注队列”)的物质,因此该类化合物应在药品中应予以严格控制。目前美国和欧盟的药品监管机构已陆续发布公告,对不同供应商的不同沙坦类原料药采取了风险控制措施。美国FDA于1月18日至1月23日相继发布公告,多批次沙坦类药物加入了召回的行列。本次致癌事件持续了半年的时间。从去年7月至今,各国相关机构发布了多次公告、警告。
原料药致癌事件梳理
2018年7月5日,欧盟医药管理局(EMA)发布公告, 我国某药厂供应的缬沙坦原料未知杂质中检测出极微量的基因毒性杂质亚硝基二甲胺(NDMA),据此在成员国召回使用该药业供应缬沙坦原料生产的药品。
7月7日,该涉事药厂发布公告:基于风险防范考虑,该药业将NDMA和NDEA(亚硝基二乙胺)两项杂质的风险排查范围扩大到所有沙坦类产品。
10月,印度Aurobindo制药因产品存在NDEA杂质宣布在美召回22批厄贝沙坦原料药。
11月8日,诺华旗下山德士公司宣布在美国召回一个批次的氯沙坦氢氯噻嗪片,原因是来自该涉事药业的原料药中含有NDEA杂质。
该涉事药厂在去年11月10日和11月12日先后发布说明公告称,公司对2016年至2018年生产的500多批次氯沙坦钾样品检测的NDEA含量均低于根据EMA和FDA提供的缬沙坦NDEA报告限度推算的氯沙坦钾NDEA可接受限度标准及日本官方公布的氯沙坦钾NDEA可接受限度标准。
该药业2019年1月8日晚发布公告,公司对2015年至2018年生产并销往欧美市场的原料药效期内所有共计1163批次厄贝沙坦原料药进行的追溯检测结果显示,其中1136批次的检测结果均符合可接受限度标准。剩余27批次启动召回。
1月16日,中国药审中心就<关于在原料药工艺中生成亚硝胺类化合物的风险警示>公开征求意见。药审中心在文献调研和反应机理分析的基础上,组织起草了<关于在原料药工艺中生成亚硝胺类化合物的风险警示>,拟为原料药研究和生产中存在生产亚硝胺类化合物风险的情况提供技术参考,现向社会各界公开征求意见。
1月18日,FDA发布声明,提醒患者和医疗保健专业人员自愿召回一批厄贝沙坦和七批厄贝沙坦和氢氯噻嗪(HCTZ)组合片剂,由Solston Healthcare LLC(一家Prinston Pharmaceutical Inc.子公司)分销。
1月23日,Torrent制药正在进一步扩大其自愿召回范围,包括另外六批氯沙坦钾和氢氯噻嗪组合片,共计16批含氯沙坦的药物。召回是由于Hetero Labs Limited生产的氯沙坦活性药物成分中不可接受量的N-亚硝基二乙胺(NDEA)。
2月8日,辉瑞日本分公司表示,因缬沙坦原料药含有可能致癌的杂志,目前正从日本召回4批次超25万片降压药Amubaro。
2019年3月1日,美国FDA在其官网上更新了缬沙坦致癌事件的最新调查报告,该调查涉及最近对用于治疗高血压和心力衰竭的多种通用血管紧张素II受体阻滞剂(ARB)药品的自愿召回。
聚焦沙坦类药物
沙坦类药物可以直接通过拮抗血管紧张素受体,从而达到扩张血管,减少血流阻力,从而达到降压效果。这类药物不仅可以扩张动脉血管,还可以扩张静脉血管,是一种作用良好的降压药;同时,这类药物还可用于高血压相关合并症的治疗中,引发干咳的几率较低。所以,沙坦类药物是目前常用的高血压一线治疗药物。原料药是药品生产的基石,是药品质量的关键,沙坦类原料药致癌,自然影响深远。
原研药企原料药企未受影响
作为厄贝沙坦和厄贝沙坦氢氯噻嗪的原研厂家,赛诺菲此前发布声明中称,其未在法国里昂设立生产工厂,其生产的厄贝沙坦类药物采用的是自产厄贝沙坦原料、独特的内部制造工艺,从源头及生产过程中保证其旗下两种原研沙坦类药物不含亚硝胺杂质。
本次原料药致癌事件召回还在继续,但是沙坦类药物在临床中应用甚广。医师在临床工作中应注意相关药物的使用,以免对健康造成可能的损害。
FDA原文报道链接
-
https://www.fda.gov/Drugs/DrugSafety/ucm613916.htm
-
https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm632425.htm
|