|
自2017年12月22日, CDE发布关于公开征求<已上市化学仿制药(注射剂)一致性评价技术要求>意见以来,2019年11月又再次进行征求意见,历时两年半的热身时间,注射剂一致性评价正式启动,也意味着药品一致性评价由口服制剂向注射剂全面延伸,最大和影响面最广的一块市场将带来巨大洗牌。2020年5月14日,药监局发布<关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告>。同日,CDE发布<化学药品注射剂仿制药质量和疗效一致性评价技术要求>、<化学药品注射剂仿制药质量和疗效一致性评价申报资料要求>、<化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求>等三个细节文件。
一:注射剂一致性评价主要要求
(哪些药品需要开展?)已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。(参比制剂如何选择?)依据国家药品监督管理局发布的<仿制药参比制剂目录>选择参比制剂,开展一致性评价研发申报。尚未收载入<仿制药参比制剂目录>的品种,药品上市许可持有人应当按照<国家药监局关于发布化学仿制药参比制剂遴选与确定程序的公告>(2019年第25号)规定申报参比制剂,待参比制剂确定后开展一致性评价研发申报,避免出现因参比制剂选择与国家公布的参比制剂不符,影响研究项目开展、造成资源浪费等问题。(时间限制?)根据<国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)>的要求,时间服从质量,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期。逾期再未完成的,不予再注册。(审评时效?)审评时限要求在受理后120日内完成。经审评认为需申请人补充资料的,申请人应在4个月内一次性完成补充资料。
二:重点关注
总体而言,注射剂一致性评价要求,需要综合考虑各种剂型的无菌保证水平、杂质的控制水平、工艺的可行性、临床使用的方便。
普通注射剂要求仿制药的原辅料与原研相同,意即Q1、Q2相同,辅料的用量为参比制剂相应辅料用量的 95%—105%,仅抑菌剂、缓冲剂、pH调节剂、抗氧剂、金属离子络合剂可以有不同的处方,但需阐述选择的理由,并研究证明上述不同不影响所申请产品的安全性和有效性。一般而言,处方好模仿,但配制工艺很难复制成功,仿制药企业可能需要做更多的工作,这意味着对原研的解析更加彻底和完整。
注射剂的原辅料质量是关键,仿制药厂家需要对原料药来源和质量进行全面的审计和评估,同时还需要在后续的商业化生产中保证供应链的稳定。 从这一点而言,未来注射剂没有原料的,不管是供应链的稳定(说白了就是价格)还是质量的控制,都将很难有竞争优势。
注射剂更加关注的是安全性问题,根据<国家药品不良反应监测年度报告(2019)>统计,在2019年不良反应/事件报告中,注射剂占62.8%(其中静脉给药92.5%,其他注射给药7.5%),口服给药占32.5%,其他给药途径占4.7%。因此注射剂一致性评价对于无菌/灭菌工艺的技术要求更高,在工艺验证方面需要做大量的工作。
三:申报现状与头部抢跑企业
2018年4月,首个注射剂一致性评价申报,随后申报的速度逐步加快。截止 2021年5月 15 日,CDE 共承办了 719个一致性评价注射剂受理号,涉及 157个注射剂品种和 162 家抢跑的企业。有33个通过或视同通过注射剂一致性评价。
2年半的准备时间,已经有不少头部企业已经抢先进入赛道。
|
一致性评价申请号
|
一致性评价品种数
|
4类申请号
|
4类申请品种数
|
|
四川科伦
|
54
|
31
|
16
|
11
|
|
齐鲁制药
|
45
|
24
|
11
|
6
|
|
扬子江药业
|
37
|
26
|
26
|
16
|
|
江苏恒瑞
|
24
|
17
|
7
|
4
|
|
成都倍特
|
23
|
14
|
3
|
4
|
|
宜昌人福
|
22
|
10
|
|
|
|
江苏豪森
|
21
|
9
|
2
|
2
|
|
正大天晴
|
21
|
14
|
6
|
4
|
|
山东齐都
|
19
|
5
|
2
|
1
|
|
江苏奥赛康
|
18
|
11
|
|
|
|
石药集团
|
18
|
10
|
3
|
3
|
|
石家庄四药
|
17
|
13
|
5
|
4
|
|
福安药业集团
|
16
|
11
|
4
|
4
|
|
四川国瑞
|
14
|
8
|
|
|
|
广东嘉博
|
13
|
4
|
3
|
3
|
|
成都苑东
|
12
|
5
|
|
|
|
南京正大天晴
|
11
|
6
|
5
|
3
|
|
昆明积大制药
|
10
|
4
|
|
|
|
辽宁海思科
|
10
|
7
|
1
|
1
|
|
山东润泽
|
10
|
2
|
|
|
一些产品已经非常拥挤。
|
申报厂家数
|
申报号数
|
|
盐酸氨溴索注射液
|
17
|
33
|
|
注射用奥美拉唑钠
|
15
|
16
|
|
注射用头孢曲松钠
|
14
|
41
|
|
注射用帕瑞昔布钠
|
12
|
23
|
|
注射用头孢他啶
|
12
|
22
|
|
注射用泮托拉唑钠
|
9
|
12
|
|
注射用艾司奥美拉唑钠
|
9
|
13
|
|
注射用头孢米诺钠
|
8
|
15
|
|
注射用培美曲塞二钠
|
7
|
12
|
|
盐酸右美托咪定注射液
|
7
|
10
|
|
多索茶碱注射液
|
7
|
14
|
|
依达拉奉注射液
|
7
|
8
|
|
注射用阿奇霉素
|
7
|
11
|
可以想见,未来会有很多注射剂低于每支1元。以后药企开会可以在桌上只摆生理盐水了,因为矿泉水太贵。
值得关注的是培美曲塞二钠,四川汇宇2017年9月29日500mg和100mg以新注册分类申报获批上市,视同通过一致性评价,按照2018年102号文要求,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价,否则不予以再注册(虽然有所谓的延期申请,但笔者不认为在其他厂家已经通过的情况下,即使是属于临床必需、市场短缺品种的,很大可能监管部门也不会同意延期)。因此,一致性评价关门时间将是2020年9月28日。注射用培美曲塞二钠国内获批的仿制厂家共有14家34个文号(除去汇宇及其2个文号),迄今为止,申报一致性评价的只有7家12个文号,还有近半的厂家尚未申报。
四:影响多大
到2020年5月15日,化药仿制注射剂共32100个批准文号,涉及到820个品种,近800家药企,6355亿的市场。
来自米内网的数据显示,中国包括城市公立、城市社区、县级公立、乡镇卫生在内的化药注射剂市场总体在6355亿。由于限抗、输液限制、辅助药限制使用等等管理措施,注射剂市场的增长率在逐年下降,2019年已经降到3.27%。
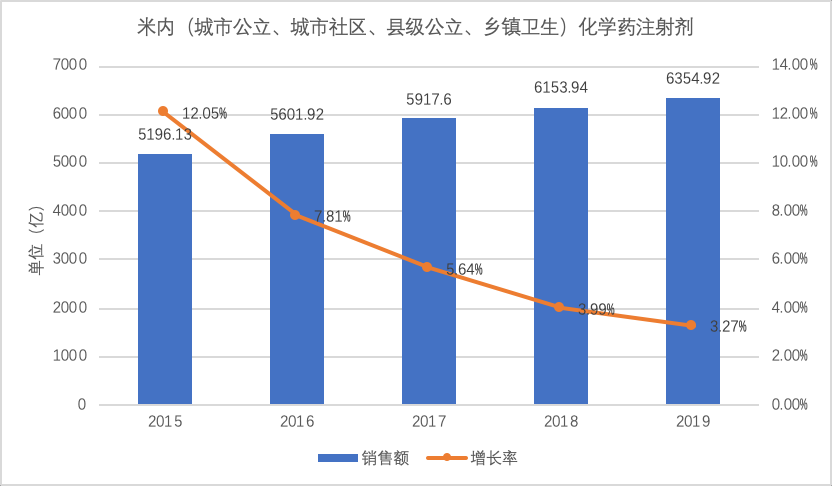
按照口服固体制剂通过一致性评价后的集采竞争结果,未来的注射剂仿制药市场可能会被压缩到4000~4500亿左右,当然,这会是起码5年左右的逐步洗牌。
这样的一块蛋糕,对于很多药企而言,是机会,是重新洗牌,也是去产能大浪淘沙的过程。当然,蛋糕看上去很大,但能不能吃到嘴里还是个问题;需要花多少钱,付出多大的代价才能吃又是一个问题。
五:做还是不做
这是一个两难选择。从口服固体制剂的一致性评价历程可以看到,不做早死,做的等死。不过,总体而言还是要做后浪死在后面比较好。
当然,有很多因素需要权衡,如果:
1、没有临床价值,没有市场总量,建议放弃,免得连一致性评价的本都赚不回来;
2、原料、生产成本、竞争赛道等是否有先发优势,是否有控制优势。没有优势的话,赚个打酱油的钱,盘活生产线,保有文号。这就看企业自己的产品策略了。
3、有保有弃是必须的。
总而言之,对于一些一直以提升产品质量、准备做好应对全球化竞争的本土企业而言,注射剂一致性评价是个驱动力,不仅通过提升产品质量,做好全球化竞争准备,还可以通过提高成本控制能力,打造未来全球供应链体系。经历过口服固体制剂、注射剂一致性评价的中国本土企业,在面临全球仿制药乃至参与到创新药竞争,将更有自信,更游刃有余。
|